题目内容
7.实验室制取气体时,发生装置相同的组合是( )| A. | HCl Cl2 | B. | H2 HCl | C. | CO2 Cl2 | D. | HCl CO2 |
分析 根据实验室制取气体选择装置依据是反应物状态和反应条件选择,结合气体的反应原理来分析试剂和使用的仪器,从而确定装置.
A、HCl、Cl2是固体和液体加热反应制备;
B、氢气是固体和液体不加热反应生成气体,HCl是固体和液体加热反应制备;
C、二氧化碳是固体和液体不加热反应生成气体,Cl2是固体和液体加热反应制备;
D、HCl是固体和液体加热反应,制备二氧化碳是固体和液体不加热反应生成气体.
解答 解:A、HCl、Cl2是固体和液体加热反应制备,实验室制取气体时,发生装置相同的组合,故A正确;
B、氢气是固体和液体不加热反应生成气体,HCl是固体和液体加热反应制备,实验室制取气体时,发生装置不相同,故B错误;
C、二氧化碳是固体和液体不加热反应生成气体,Cl2是固体和液体加热反应制备实验室制取气体时,发生装置是不相同的组合,故C错误;
D、HCl是固体和液体加热反应,制备二氧化碳是固体和液体不加热反应生成气体,实验室制取气体时,发生装置是不相同的组合,故D错误;
故选A.
点评 本题考查了实验室制备气体的原理和装置选择方法,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
2.下列实验操作可以达到实验目的是( )
| A. | 用分液漏斗分离乙醇和水的混合物 | |
| B. | 将蔗糖溶于水,加热几分钟后再加入少量新制的Cu(OH)2就可实现将蔗糖水解,并用新制的Cu(OH)2检验蔗糖的水解产物 | |
| C. | 只用溴的四氯化碳溶液就能鉴别乙烷与乙烯 | |
| D. | 用NaOH除去乙酸乙酯中的少量乙酸. | |
| E. | 向某溶液中加入NaOH溶液后再加热,若能产生使湿润红色石蕊试纸变蓝的气体,则该溶液中肯定有NH4+ | |
| F. | 现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下充分反应,有2 mol NH3生成 | |
| G. | 将乙醇迅速加热至170摄氏度制乙烯 |
12.已知硫酸溶液的质量分数越大时,其溶液的密度越大且密度都大于1g/ml,现将90%和10%的两种H2SO4溶液等体积混合后,溶液的质量分数为( )
| A. | 大于50% | B. | 等于50% | C. | 小于50% | D. | 无法确定 |
19.①~⑨所代表的元素均在元素周期表前4周期,按原子半径递增的顺序进行排列,它们的主要化合价如表所示.其中⑦是过渡金属,且M层排满,未成对电子数为1,其余为主族元素.
(1)元素②在周期表中的位置是第二周期第ⅤⅡA族,②③④中第一电离能最小的元素符号是O.
(2)元素⑤的氢化物的空间构型是V型,元素⑥的氢化物中心原子的杂化方式是sp3,元素④⑥的氢化物的沸点由高到低的顺序是NH3(填分子式),理由是氨分子之间有氢键.
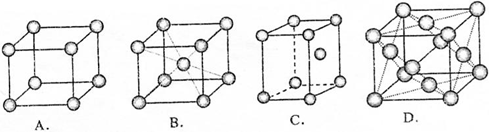
(3)元素⑨单质晶体的原子堆积方式是B.
(4)⑦的基态原子核外电子排布式为1s22s22p63s23p63d104s1,它的硫酸盐、氯化物、溴化物溶于足量的水以后呈相似的颜色,原因是在这些溶液中都含有相同的配离子是[Cu(H2O)4]2+.
(5)都由元素①③⑤⑧组成的两种化合物发生的离子反应方程式是HSO3-+H+=H2O+SO2↑.
| 代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
| 半径(pm) | 30 | 64 | 66 | 70 | 106 | 108 | 128 | 186 | 232 |
| 主要化合价 | +1,-1 | -1 | -2 | -3,+5 | -2,+4,+6 | -3,+5 | +2 | +1 | +1 |
(2)元素⑤的氢化物的空间构型是V型,元素⑥的氢化物中心原子的杂化方式是sp3,元素④⑥的氢化物的沸点由高到低的顺序是NH3(填分子式),理由是氨分子之间有氢键.
(3)元素⑨单质晶体的原子堆积方式是B.

(4)⑦的基态原子核外电子排布式为1s22s22p63s23p63d104s1,它的硫酸盐、氯化物、溴化物溶于足量的水以后呈相似的颜色,原因是在这些溶液中都含有相同的配离子是[Cu(H2O)4]2+.
(5)都由元素①③⑤⑧组成的两种化合物发生的离子反应方程式是HSO3-+H+=H2O+SO2↑.
17.下列物质中,一定不是天然高分子化合物的是( )
| A. | 纤维素 | B. | 橡胶 | C. | 蛋白质 | D. | 腈纶 |

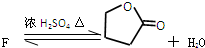
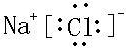 、
、 ;
;