题目内容
2.下列有关物质的性质和该性质的应用均正确的是( )| A. | 氧化铝具有很高的熔点,故可用于制造耐高温材料 | |
| B. | 常温下铝与浓硫酸不发生反应,故常温下可用铝制容器贮运浓硫酸 | |
| C. | 碳酸钠可与盐酸反应,故常用于治疗胃溃疡病人的胃酸过多症 | |
| D. | 二氧化硫、潮湿的氯气均具有漂白性,故两者混合使用漂白效果会更好 |
分析 A、高熔点的物质能作耐高温耐火材料;
B、常温下,浓硝酸和铝发生钝化现象;
C、碳酸钠碱性太强生成气体多;
D、氯气和二氧化硫皆可做漂白剂,若用两者(体积比1:1)一起漂白一种物质时,发生Cl2+SO2+H20=2HCl+H2SO4,以此来解答.
解答 解:A、高熔点的物质能作耐高温耐火材料,氧化铝熔沸点较高,所以可以做耐高温耐火材料,故A正确;
B、常温下,浓硝酸和铝发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象是钝化现象,所以常温下,可以用铁制容器盛装浓硝酸,故B错误;
C、碳酸钠的碱性太强,易发生胃穿孔,不能用来中和胃酸,故C错误;
D、氯气和二氧化硫皆可做漂白剂,若用两者(体积比1:1)一起漂白一种物质时,发生Cl2+SO2+H20=2HCl+H2SO4,盐酸、硫酸均不具有漂白性,则无漂白性,故D错误,
故选A.
点评 本题主要考查了碳酸钠、氧化铝、铝、二氧化硫等物质的性质,掌握二氧化硫的漂白性原理、物质的性质是解答该题的关键,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
17.检验1-溴丙烷中含有溴元素的实验步骤、操作和顺序正确的是:( )
①加入AgNO3溶液;②加入NaOH溶液;③加入适量HNO3;④加热;⑤取上层液体.
①加入AgNO3溶液;②加入NaOH溶液;③加入适量HNO3;④加热;⑤取上层液体.
| A. | ②④⑤③① | B. | ①③ | C. | ②④⑤① | D. | ①④ |
11.按卤素原子序数递增的顺序,下列递变关系不正确的是( )
| A. | 原子半径依次增大 | B. | 气态氢化物的稳定性依次减弱 | ||
| C. | 气态氢化物水溶液的酸性依次减弱 | D. | 气态氢化物的还原性依次增强 |

 ,B→G
,B→G
 ,E
,E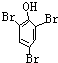 .
.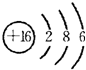 ,
,
 ,用电子式表示AB2的形成过程
,用电子式表示AB2的形成过程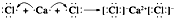 .
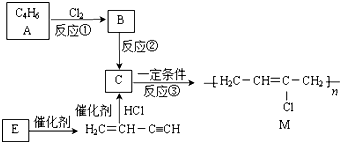
.
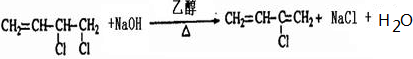 .
. .
.