题目内容
12.工业上可由有机化工原料A或E制得橡胶M,它是理想的电线电缆材料,其合成路线如图所示.(二聚指两个相同的分子聚合为一个分子的过程,三聚、四聚同理)已知:H2C=CH-C≡CH由E二聚得到.
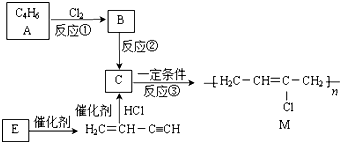
完成下列填空:
(1)A的名称是1,3-丁二烯
(2)写出反应②的化学反应方程式
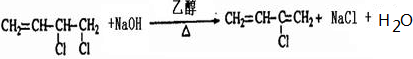 .
.(3)写出将E三聚成环状化合物的结构简式
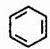 .
.(4)以下是由A制备工程塑料PB的原料之一1,4-丁二醇(BDO)的合成路线:

写出上述由A制备BDO过程中反应⑤的化学反应方程式.CH2Cl-CH=CHCH2Cl+2NaOH$\stackrel{H_{2}O}{→}$CH2OH-CH=CHCH2OH+2NaCl.
分析 由合成图和M的结构简式可知C为 ,反应③为加聚反应生成高分子;结合C的结构可知,由A的分子式可知,A为链状,应含有2个C=C双键,则A为H2C=CH-CH=CH2,B为H2C=CH-CH=CH2与氯气发生1,2-加成产物,B为
,反应③为加聚反应生成高分子;结合C的结构可知,由A的分子式可知,A为链状,应含有2个C=C双键,则A为H2C=CH-CH=CH2,B为H2C=CH-CH=CH2与氯气发生1,2-加成产物,B为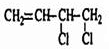 ,在碱的醇溶液中发生消去反应生成C;利用题中信息,H2C=CH-C≡CH由E二聚得到,则E为HC≡CH,三聚环状产物为苯、四聚得到的环状产物为环辛四烯,鉴别苯与环辛四烯可用溴水(苯发生萃取而使溴水褪色、环辛四烯则与溴发生加成反应使溴水褪色)或酸性高锰酸钾溶液(苯不能使酸性高锰酸钾溶液褪色、环辛四烯能使酸性高锰酸钾溶液褪色),据此解答.
,在碱的醇溶液中发生消去反应生成C;利用题中信息,H2C=CH-C≡CH由E二聚得到,则E为HC≡CH,三聚环状产物为苯、四聚得到的环状产物为环辛四烯,鉴别苯与环辛四烯可用溴水(苯发生萃取而使溴水褪色、环辛四烯则与溴发生加成反应使溴水褪色)或酸性高锰酸钾溶液(苯不能使酸性高锰酸钾溶液褪色、环辛四烯能使酸性高锰酸钾溶液褪色),据此解答.
解答 解:(1)由合成图和M的结构简式可知C为 ,利用C的结构简式和A的分子式可知A为1,3-丁二烯,
,利用C的结构简式和A的分子式可知A为1,3-丁二烯,
故答案为:1,3-丁二烯;
(2)反应②是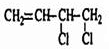 在碱的醇溶液中发生消去反应生成
在碱的醇溶液中发生消去反应生成 ,反应方程式为:
,反应方程式为: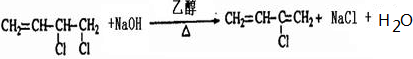 ,
,
故答案为: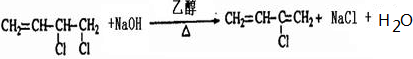 ;
;
(3)利用题中信息H2C=CH-C≡CH由E二聚得到,则E为HC≡CH,三聚环状产物为 ,
,
故答案为: ;
;
(4)1,4-丁二醇(BDO)为CH2OH-CH2CH2CH2OH,根据A的分子式可知A应含有2个C=C,与氯气的反应生成1,4加成,生成CH2Cl-CH=CHCH2Cl,CH2Cl-CH=CHCH2Cl在碱性条件下发生水解,生成CH2OH-CH=CHCH2OH,反应的方程式为CH2Cl-CH=CHCH2Cl+2NaOH$\stackrel{H_{2}O}{→}$CH2OH-CH=CHCH2OH+2NaCl,CH2OH-CH=CHCH2OH与氢气发生加成反应可生成CH2OH-CH2CH2CH2OH,
故答案为:CH2Cl-CH=CHCH2Cl+2NaOH$\stackrel{H_{2}O}{→}$CH2OH-CH=CHCH2OH+2NaCl.
点评 本题考查了有机物合成,明确物质的官能团及其性质是解本题关键,根据流程图及M结构采用逆向推导的方法进行推断,知道常见有机反应类型及反应条件,同时考查学生灵活运用知识解答问题的能力,为考试热点,题目难度中等.

| A. | 氧化铝具有很高的熔点,故可用于制造耐高温材料 | |
| B. | 常温下铝与浓硫酸不发生反应,故常温下可用铝制容器贮运浓硫酸 | |
| C. | 碳酸钠可与盐酸反应,故常用于治疗胃溃疡病人的胃酸过多症 | |
| D. | 二氧化硫、潮湿的氯气均具有漂白性,故两者混合使用漂白效果会更好 |
| A. | 某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO32- | |
| B. | 将某化合物进行焰色实验,透过蓝色钴玻璃观察,焰色为紫色,证明含K+ | |
| C. | 待检液逐滴加NaOH溶液,有白色胶状沉淀产生,后来沉淀逐渐消失,原溶液可能含有Al3+ | |
| D. | 待检液中先加氯水,无明显现象,再加入KSCN,溶液显血红色则待检液中一定含有Fe2+ |
| A. | 用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体 | |
| B. | 加热蒸发K2CO3溶液获得K2CO3晶体 | |
| C. | 加热蒸发FeCl2溶液制取Fe(OH)2固体 | |
| D. | 加热蒸发MgCl2溶液制取MgCl2固体 |
| A. | NaF=NaCl | B. | NaF>NaCl | C. | NaF<NaCl | D. | 无法确定 |
| A. | pH=1的溶液中:K+、Fe2+、MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO${\;}_{4}^{2-}$、SCN- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH${\;}_{4}^{+}$、Al3+、NO${\;}_{3}^{-}$、Cl- | |
| D. | 与铝反应生成氢气的溶液中:NH${\;}_{4}^{+}$、K+、Cl-、SiO${\;}_{3}^{2-}$ |
 ,B
,B ,C
,C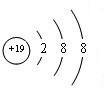 ,D
,D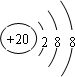 .它们离子的半径由大到小的顺序是r(S2-)>r(Cl-)>r(K+)>r(Ca2+).
.它们离子的半径由大到小的顺序是r(S2-)>r(Cl-)>r(K+)>r(Ca2+).
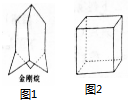 金刚烷、立方烷的合成在有机合成史上具有理论意义.
金刚烷、立方烷的合成在有机合成史上具有理论意义.