题目内容
6.将等质量的两份锌粉a和b,分别加入两个盛过量的稀硫酸的烧杯中,并向加入a的烧杯中再加入少量CuO粉末.下列各图表示氢气体积V(H2)与反应时间t的关系,其中正确的是( )| A. |  | B. | 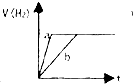 | C. | 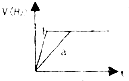 | D. | 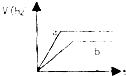 |
分析 a烧杯中加入一定量的CuO粉末,CuO与H2SO4反应生成CuSO4,Zn与CuSO4反应,析出Cu附着在Zn上,构成原电池,a烧杯内反应速率快;a烧杯内与H2SO4反应的Zn的质量比b烧杯少,a烧杯内生成的氢气体积V(H2)比b烧杯少.
解答 解:a烧杯中形成原电池,反应速率快,但a中与酸反应的Zn少,则生成的氢气少,
A、a烧杯内反应速率快,生成的氢气体积V(H2)少,故A正确;
B、a烧杯内生成的氢气体积V(H2)少,不可能一样多,故B错误;
C、a烧杯内反应速率快,生成的氢气体积V(H2)少,故C错误;
D、a烧杯内生成的氢气体积V(H2)少,故D错误.
故选A.
点评 本题考查原电池对反应速率的影响及图象的分析,清楚整个反应过程,正确分析曲线与变化的关系,原电池的构成,对反应速率及氢气体积的影响等即可解答.

练习册系列答案
相关题目
16.下列关于物质的检验说法正确的是( )
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子 | |
| B. | 加入盐酸,放出能使澄清的石灰水变浑浊的无色无味的气体,证明一定含有CO32- | |
| C. | 加入AgNO3溶液,有白色沉淀生成,证明含有Cl- | |
| D. | 用四氯化碳萃取某溶液时,分层且下层显紫红色,可能存在碘单质 |
17.“纳米材料”是当今材料科学的前沿.所谓“纳米材料”是指研究开发出的直径在几纳米到几十纳米之间的材料.若将纳米材料分散到分散剂中,所形成的混合物可能具有的性质是( )
| A. | 能全部透过半透膜 | B. | 有丁达尔现象 | ||
| C. | 不能全部透过滤纸 | D. | 所得物质一定是悬浊液 |
11.海水是一个巨大的化学资宝库,下列有关海水综合利用的说法,正确的是( )
| A. | 海水中含有氢、氧元素,所以可以使用物理方法从海水中得到氢气 | |
| B. | 从海水中可以得到NaCl,电解NaCl溶液可得到金属钠 | |
| C. | 从海水中提取Br2、I2的过程中发生了氧化还原反应 | |
| D. | 海水蒸发制海盐的过程中只发生了化学变化 |
18.现有一体积为V mL、密度为ρ g•cm-3的溶液,含有相对分子质量为M的溶质m g,其物质的量浓度为c mol•L-1,溶质的质量分数为W,下列表示式中不正确的是( )
| A. | c=$\frac{1000Wρ}{M}$ | B. | m=$\frac{VρW}{10000}$ | C. | W%=$\frac{cM}{1000ρ}$% | D. | c=$\frac{1000m}{VM}$ |
15.有人制造了一种甲烷燃料电池,一个电极通入空气,另一个电极通入甲烷,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.以下判断错误的是( )
| A. | 电池的正极发生的反应:O2+4e-═2O2- | |
| B. | 负极发生的反应:CH4+4O2--8e-═CO2+2H2O | |
| C. | 固体电解质里的O2-的移动方向:由正极流向负极 | |
| D. | 向外电路释放电子的电极:正极(电子由正极流向负极) |
16.下列物质属于同系物的一组是( )
| A. | CH4与C2H4 | B. | 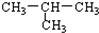 与 CH3-CH2-CH2-CH3 与 CH3-CH2-CH2-CH3 | ||
| C. | C2H6与C3H8 | D. | C2H4与C3H6 |