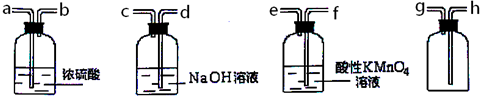
题目内容
13.在20℃时,在一刚性容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室.左室充入氮气,右室充入氢气与氧气的混和气体,活塞恰好停留在离左端的1/5处(图1),然后引燃氢、氧混和气体,反应完毕后恢复至原来温度,活塞恰好停在中间(图2),如果忽略水蒸气体积,则反应前氢气与氧气的体积比可能是( )
| A. | 3:1 | B. | 4:5 | C. | 2:1 | D. | 3:2 |
分析 左右压强相等,气体的物质的量之比等于体积之比,反应后恢复至原来的温度,活塞正好停留在容器的中间,说明反应后左右气体的物质的量相等,根据方程式计算.
解答 解:设氮气的物质的量为1mol,左室充入N2,右室充入H2和O2,活塞正好使N2占容器体积的$\frac{1}{5}$,左右压强相等,气体的物质的量之比等于体积之比,则H2和O2的物质的量为4mol,点燃H2和O2的混合气体,反应方程式为2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,反应后活塞正好停留在容器的中间.说明反应后左右气体的物质的量相等,右室中气体的物质的量为1mol,则反应的H2和O2共为3mol,如果剩余是氢气,其中n(H2)=3mol,n(O2)=1mol,其体积之比为3:1;如果剩余气体是氧气,则原气体中n(H2)=2mol,n(O2)=2mol,二者的物质的量之比为1:1,
故选A.
点评 本题考查了阿伏伽德罗定律及其推论,明确气体体积与物质的量的关系是解本题关键,注意平衡状态时两边容器内压强相等,题目难度中等.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
3.硫代硫酸钠(Na2S2O3)俗称海波,它可看成是用一个S原子取代了Na2SO4中的一个O原子而形成.某校化学研究性学习小组运用类比学习的思想,并通过实验探究Na2S2O3的化学性质.
提出问题:Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
实验探究:取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究.
实验结论:
探究①:Na2S2O3呈碱性,能与强酸反应.探究②:具有还原性.
问题讨论:甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化.你认为该方案不正确(填“正确,”或“不正确”),理由是因氯水过量,氯水中同样含有Cl-.
提出问题:Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
实验探究:取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究.
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
| 探究① | A.用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 | a.溶液pH=8 | i.S2O32-+H2O?HS2O3-+OH- |
| B.向pH=2的硫酸中滴加Na2S2O3溶液 | b.有淡黄色沉淀(或乳白色浑浊)和无色刺激性气味气体产生 | ii.S2O32一+2H+=S↓+SO2↑ +H2O | |
| 探究② | C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | c.氯水颜色变浅 | iii.S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ |
探究①:Na2S2O3呈碱性,能与强酸反应.探究②:具有还原性.
问题讨论:甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化.你认为该方案不正确(填“正确,”或“不正确”),理由是因氯水过量,氯水中同样含有Cl-.
4.利用某些有机物的同分异构体间的转化可用来贮存热能,如原降冰片二烯(NBD)经太阳照射后转化成四环烷(Q)的反应: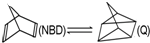 △H=+88.62kJ•mol-1,下列说法不正确的是( )
△H=+88.62kJ•mol-1,下列说法不正确的是( )
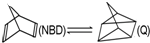 △H=+88.62kJ•mol-1,下列说法不正确的是( )
△H=+88.62kJ•mol-1,下列说法不正确的是( )| A. | 92gNBD经太阳照射后完全转化为Q时需吸收88.62kJ热量 | |
| B. | NBD可开发为贮能材料 | |
| C. | NBD、Q、甲苯三者互为同系物 | |
| D. | NBD、Q、甲苯三者是同分异构体 |
1. 如图是两个反应反应前后反应物总能量和生成物总能量的比较图,对于A、B两个反应的说法正确的是( )
如图是两个反应反应前后反应物总能量和生成物总能量的比较图,对于A、B两个反应的说法正确的是( )
 如图是两个反应反应前后反应物总能量和生成物总能量的比较图,对于A、B两个反应的说法正确的是( )
如图是两个反应反应前后反应物总能量和生成物总能量的比较图,对于A、B两个反应的说法正确的是( )| A. | A反应必须加热,B反应不需要加热 | |
| B. | A反应是放热反应,B反应是吸热反应 | |
| C. | A反应是吸热反应,B反应是放热反应 | |
| D. | A反应不需要加热,B反应必须加热 |
8.下列说法不正确的是( )
| A. | 对处于平衡状态的2HI(g)?H2(g)+I2(g)反应,缩小体积后混合物颜色变深 | |
| B. | 在恒温时,一固定容积的容器内发生如下反应:2NO2(g)?N2O4(g)达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数减小 | |
| C. | 对于可逆反应FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)达到平衡后,向反应体系中加入KCl固体,平衡向逆反应方向移动 | |
| D. | 合成氨时适当增大压强有利于提高氢气的转化率 |

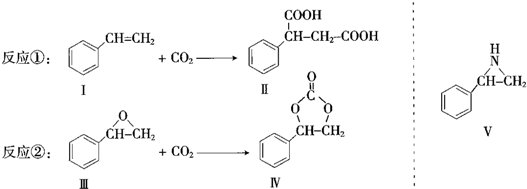
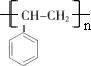 .
.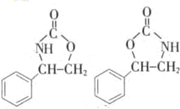 (任写一种).
(任写一种).