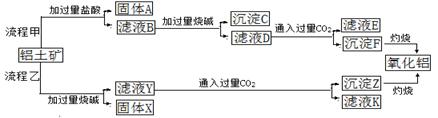
题目内容
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
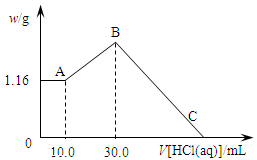
(1)A点的沉淀物的化学式为 。
(2)写出A点至B点发生反应的离子方程式: 。
(3)原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的体积为 mL。

(1)A点的沉淀物的化学式为 。
(2)写出A点至B点发生反应的离子方程式: 。
(3)原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的体积为 mL。
(1)Mg(OH)2 (2)AlO2-+H++H2O=Al(OH)3↓ (3)5.20 130.0
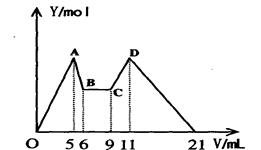
试题分析:(1)向所得浊液中,逐滴加入1.00mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:①0~10ml,随盐酸的体积增加,生成沉淀的质量不变,说明氢氧化钠过量,加入的盐酸与氢氧化铝先反应,方程式为NaOH+HCl=NaCl+H2O。因此A点沉淀是Mg(OH)2,其质量是1.16g,物质的量n=
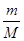 =
=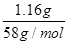 =0.02mol。则根据原子守恒可知原混合物中氯化镁的物质的量=0.02mol。
=0.02mol。则根据原子守恒可知原混合物中氯化镁的物质的量=0.02mol。(2)NaOH、AlCl3、MgCl2组成的混合物,溶于足量水发生反应是:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O。NaOH过量,溶液是NaCl、NaAlO2和NaOH的混合液,则A~B阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓。
(3)A~B阶段消耗盐酸的物质的量=(0.03L-0.01L)×1.0mol/L=0.02mol,则根据方程式NaAlO2+HCl+H2O=Al(OH)3↓+NaCl可知生成氢氧化铝的物质的量=0.02mol。所以根据原子守恒可知原混合物中氯化铝的物质的量是0.02mol。B点沉淀达到最大值,此时的沉淀是氢氧化镁和氢氧化铝的混合物。而溶液则恰好是氯化钠溶液。根据氯离子守恒可知氯化钠的物质的量=0.03L×1.00mol/L+0.02mol×2+0.02mol×3=0.13mol。所以根据钠离子守恒可知,氢氧化钠的物质的量也是0.13mol,因此氢氧化钠的质量m=n· M=40g/mol×0.13mol=5.2g。B~C阶段加入的盐酸开始溶解氢氧化铝和氢氧化镁,此时反应的方程式为Mg(OH)2+2HCl=MgCl2+2H2O;Al(OH)3+3HCl=AlCl3+3H2O。根据氢氧化镁和氢氧化铝均是0.02mol可知,该阶段消耗盐酸的物质的量是0.02mol×2+0.02mol×3=0.10mol,其体积是0.10mol÷1mol/L=0.1L=100ml,所以C点(此时沉淀恰好完全溶解)HCl溶液的体积为30ml+100ml=130ml。

练习册系列答案
相关题目