题目内容
6.下列应用不涉及氧化还原反应的是( )| A. | 工业上用石灰乳与氯气制漂白粉 | B. | 工业上电解熔融状态Al2O3制备Al | ||
| C. | 工业上利用合成氨实现人工固氮 | D. | 自来水厂用明矾做净水剂 |
分析 判断物质发生反应时,所含元素的化合价是否发生变化,如化合价发生变化,则发生氧化还原反应.
解答 解:A.工业制取漂白粉,用氯气和石灰乳反应生成氯化钙、次氯酸钙和水,存在化合价的变化,为氧化还原反应,故A不选;
B.工业上电解熔融状态Al2O3制备Al,Al、O元素存在化合价的变化,为氧化还原反应,故B不选;
C.合成氨实现人工固氮存在N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3的反应,为氧化还原反应,故C不选;
D.自来水厂用明矾做净水剂,铝离子水解生成氢氧化铝胶体,没有化合价变化,则不涉及氧化还原反应,故D选.
故选D.
点评 本题考查氧化还原反应,题目难度不大,本题注意常见工业生产原理,注重基础知识的积累.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
17.分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有( )
| A. | 15种 | B. | 28种 | C. | 32种 | D. | 40种 |
14.某小组在某温度下测定溶液的pH时发现,0.01mol/L的NaOH溶液中,c(H+)•c(OH-)=10-12(mol•L-1)2,则该小组在该温度下测得0.1mol•L的NaOH溶液pH值应为( )
| A. | 13 | B. | 13 | C. | 11 | D. | 10 |
1.若NA表示阿伏伽德罗常数,下列叙述中正确的是( )
| A. | 1mol含8个碳原子的某烃分子,最多形成8mol碳碳单键 | |
| B. | 7.2 g 过氧化钙(CaO2)固体中阴、阳离子总数为0.2NA | |
| C. | 1 mol Cl2发生反应时,转移的电子数一定是2NA | |
| D. | 精炼铜过程中阳极减轻6.4g时,电路中转移电子数一定是0.2NA |
11.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 常温下,1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| C. | 1mol羟基与1mol氢氧根离子所含电子数均为9 NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
18.下列有关实验操作正确的是( )
| A. | 向酒精灯内添加酒精时,不能多于容积的$\frac{2}{3}$,若不慎洒出的酒精在桌上燃烧,应迅速用水扑灭 | |
| B. | 中和滴定实验中,滴定管、锥形瓶用蒸馏水洗净后须再用待装液润洗后方可使用 | |
| C. | 取少量硫酸亚铁铵晶体放入试管,加入适量NaOH溶液,加热试管,在试管口用湿润的蓝色石蕊试纸检验,则可证明硫酸亚铁铵晶体的成分中含有NH4+ | |
| D. | 探究反应速率影响因素的实验中,以Na2S2O3溶液与稀硫酸反应产生沉淀的快慢为依据来比较不同条件下速率的快慢 |
 在273K(即0℃)时,向如图所示的真空密闭容器A中充入0.5g H2时,测得容器内的压强为1.01×105Pa.由此可以判断A容器的体积约为5.6L.若向A中充入的是O2,压强也是1.01×105pa,则充入的O2质量是8g,若向A容器中充入的是C0气体,使容器内压强达到3.03×105Pa.则充入C0气体的质量是21g.
在273K(即0℃)时,向如图所示的真空密闭容器A中充入0.5g H2时,测得容器内的压强为1.01×105Pa.由此可以判断A容器的体积约为5.6L.若向A中充入的是O2,压强也是1.01×105pa,则充入的O2质量是8g,若向A容器中充入的是C0气体,使容器内压强达到3.03×105Pa.则充入C0气体的质量是21g.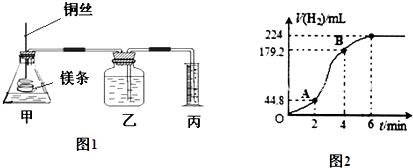
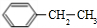 、
、 、
、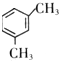 、
、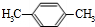 .
.