题目内容
(2007?汕头二模)(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:

①A族元素的价电子数
②第3周期元素的最高化合价
③F-、Na+、Mg2+、Al3+的离子半径
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y元素原子最外层电子数与核外电子总数之比为3:4;M元素原子的最外层电子数与电子层数之比为4:3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体.据此回答:
①Z的最高价氧化物对应的水化物的电子式为
 ,M的最高价氧化物的晶体类型为
,M的最高价氧化物的晶体类型为
③工业上制取单质M的化学方程式为

①A族元素的价电子数
2
2
.②第3周期元素的最高化合价
+7价
+7价
.③F-、Na+、Mg2+、Al3+的离子半径
a(F->Na+>Mg2+>Al3+)
a(F->Na+>Mg2+>Al3+)
.(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y元素原子最外层电子数与核外电子总数之比为3:4;M元素原子的最外层电子数与电子层数之比为4:3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体.据此回答:
①Z的最高价氧化物对应的水化物的电子式为


原子晶体
原子晶体
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1:1:1,A溶液中水的电离程度比B溶液中水的电离程度小.则化合物A中的化学键类型为离子键,共价键
离子键,共价键
,B的化学式为NaClO
NaClO
.③工业上制取单质M的化学方程式为
SiO2+2C
Si+2CO
| ||
SiO2+2C
Si+2CO
.
| ||
分析:(1)①价电子数=最外层电子数=族序数,根据族序数确定价电子数;
②元素的最高正价=最外层电子数=族序数,元素的化合价最高的为最外层电子数最多的;
③核外电子数相同,则核内质子数越多,对核外电子的吸引程度越大,半径越小;
(2)①氢氧化钠是含有离子键和共价键的离子化合物,二氧化硅属于原子晶体;
②次氯酸根水解显碱性,使水的电离程度增大,氢氧化钠属于碱,对水的电离起抑制作用;
③工业上用焦炭高温下还原二氧化硅来制备硅.
②元素的最高正价=最外层电子数=族序数,元素的化合价最高的为最外层电子数最多的;
③核外电子数相同,则核内质子数越多,对核外电子的吸引程度越大,半径越小;
(2)①氢氧化钠是含有离子键和共价键的离子化合物,二氧化硅属于原子晶体;
②次氯酸根水解显碱性,使水的电离程度增大,氢氧化钠属于碱,对水的电离起抑制作用;
③工业上用焦炭高温下还原二氧化硅来制备硅.
解答:解:(1)①价电子数=最外层电子数=族序数,故第ⅡA族元素的价电子数为2,故答案为:2;
②元素的最高正价=最外层电子数=族序数,第3周期元素氯的最高化合价为+7价,故答案为:+7价;
③核外电子数相同,则核内质子数越多半径越小,故答案为:a(F->Na+>Mg2+>Al3+);
(2)Y元素原子最外层电子数与核外电子总数之比为3:4,则最外层电子数为6,核外电子总数为8,故Y为S,M元素原子的最外层电子数与电子层数之比为4:3,则电子层数为3,最外层电子数为4,故M为Si,N-、Z+、X+的半径逐渐减小,故N为氯,Z为钠,XN常温下为气体,X为氢,
①氢氧化钠是含有离子键和共价键的离子化合物,电子式为: ,二氧化硅属于原子晶体,故答案为:
,二氧化硅属于原子晶体,故答案为: ,原子晶体;
,原子晶体;
②由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1:1:1,A溶液中水的电离程度比B溶液中水的电离程度小,则A为氢氧化钠,B为次氯酸钠,氢氧化钠中含有离子键、共价键,故答案为:离子键、共价键; NaClO;
③工业上用焦炭高温下还原二氧化硅来制备硅,方程式为:SiO2+2C
Si+2CO,故答案为:SiO2+2C
Si+2CO.
②元素的最高正价=最外层电子数=族序数,第3周期元素氯的最高化合价为+7价,故答案为:+7价;
③核外电子数相同,则核内质子数越多半径越小,故答案为:a(F->Na+>Mg2+>Al3+);
(2)Y元素原子最外层电子数与核外电子总数之比为3:4,则最外层电子数为6,核外电子总数为8,故Y为S,M元素原子的最外层电子数与电子层数之比为4:3,则电子层数为3,最外层电子数为4,故M为Si,N-、Z+、X+的半径逐渐减小,故N为氯,Z为钠,XN常温下为气体,X为氢,
①氢氧化钠是含有离子键和共价键的离子化合物,电子式为:
 ,二氧化硅属于原子晶体,故答案为:
,二氧化硅属于原子晶体,故答案为: ,原子晶体;
,原子晶体;②由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1:1:1,A溶液中水的电离程度比B溶液中水的电离程度小,则A为氢氧化钠,B为次氯酸钠,氢氧化钠中含有离子键、共价键,故答案为:离子键、共价键; NaClO;
③工业上用焦炭高温下还原二氧化硅来制备硅,方程式为:SiO2+2C
| ||
| ||
点评:本题是一道有关元素周期律和元素周期表知识的题目,考查角度广,难度较大.

练习册系列答案
相关题目

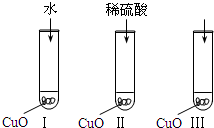 (2007?汕头二模)氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解.请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
(2007?汕头二模)氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解.请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动. (2007?汕头二模)2012年6月16日我国成功发射了“神州九号”.这标志着中国人的太空时代又前进了一大步.发射“神九”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知:
(2007?汕头二模)2012年6月16日我国成功发射了“神州九号”.这标志着中国人的太空时代又前进了一大步.发射“神九”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知: ,则苯氯乙酮不可能具有的化学性质是
,则苯氯乙酮不可能具有的化学性质是



