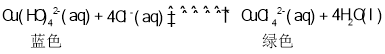题目内容
【题目】乙炔(C2H2)和丙烯腈(![]() )是有机合成工业的重要原料。工业上曾用CaC2和H2O反应制取乙炔,用乙炔和氢氰酸(HCN)在氯化亚铜等催化作用下生产丙烯腈。
)是有机合成工业的重要原料。工业上曾用CaC2和H2O反应制取乙炔,用乙炔和氢氰酸(HCN)在氯化亚铜等催化作用下生产丙烯腈。
(1) Cu+的基态核外电子排布式为________。Cu元素在周期表中位置____________。无水CuSO4晶体是白色晶体,溶于水得蓝色溶液,显蓝色的离子的化学式为___________;向蓝色的硫酸铜溶液中滴加氨水直至过量,再加入无水乙醇,最终现象是___________。
(2)![]() 的电子式为________。
的电子式为________。
(3) 与CN-互为等电子体的分子是________(填常见、稳定物质的化学式)。
(4) 丙烯腈分子中碳原子轨道的杂化类型是________。
(5) 1 mol丙烯腈分子中含π键的数目为________mol。
(6)丙烯腈(![]() )分子中共面的原子数目最多为________。
)分子中共面的原子数目最多为________。
(7)H2O分子的VSEPR模型是________,分子的立方体构型是____________。水凝结成冰,冰中水分子的配位数是__________冰的密度比水小,原因是_________。
【答案】1s22s22p63s23p63d10 第四周期ⅠB 族 [Cu(H2O)4]2+ 析出深蓝色晶体 ![]() N2或CO sp和sp2 3 7 四面体 V字形 4 氢键的方向性
N2或CO sp和sp2 3 7 四面体 V字形 4 氢键的方向性
【解析】
(1)Cu为29号元素,位于第四周期ⅠB族;电子排布式为:1s22s22p63s23p63d104s1,当3d轨道电子为全满时,较为稳定,原子失去电子时,先失去4s上面的电子,则Cu+的电子排布式为1s22s22p63s23p63d10或[Ar]3d10;无水硫酸铜溶于水生成[Cu(H2O)4]SO4,其中呈蓝色的微粒为:[Cu(H2O)4]2+;向蓝色的硫酸铜溶液中滴加氨水至过量,溶液中生成深蓝色[Cu(NH3)4]SO4,[Cu(NH3)4]SO4在无水乙醇中溶解度较低,因此向[Cu(NH3)4]SO4溶液中加入无水乙醇后,[Cu(NH3)4]SO4会析出;
(2)![]() 电子式为:
电子式为:![]() ,
,
(3)CN-为双原子微粒,核外电子总数为(6+5+1)=12,与CN-互为等电子体的稳定微粒有N2、CO;
(4)![]() 中,碳碳双键上的碳原子为sp2杂化,
中,碳碳双键上的碳原子为sp2杂化,![]() 中C与N之间为三键,则C为sp杂化,
中C与N之间为三键,则C为sp杂化,
(5)碳碳双键中一根键为π键,碳氮三键中有2根键为π键,所以1mol丙烯腈含有3molπ键,
(6)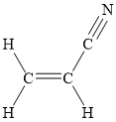 碳碳双键周边的6个原子共平面,碳碳三键上的碳原子以及直接相连的原子,共直线,现直线在碳碳双键的平面内,则所有原子均可以共平面,一共7个;
碳碳双键周边的6个原子共平面,碳碳三键上的碳原子以及直接相连的原子,共直线,现直线在碳碳双键的平面内,则所有原子均可以共平面,一共7个;
(7)H2O分子中价层电子对数为![]() ,故VSEPR模型为四面体;H2O的孤对电子对为
,故VSEPR模型为四面体;H2O的孤对电子对为![]() ,故分子立体构型为V字形;每个水分子都能缔合另外4 个水分子,形成四面体结构,所以水分子的配位数为4;因氢键具有方向性,是体积变大,使冰的密度比水小。
,故分子立体构型为V字形;每个水分子都能缔合另外4 个水分子,形成四面体结构,所以水分子的配位数为4;因氢键具有方向性,是体积变大,使冰的密度比水小。

 名校课堂系列答案
名校课堂系列答案