题目内容
17.下表是部分短周期元素的原子半径及主要化合价,以下叙述正确的是( )| 元素代号 | L | M | Q | R | T |
| 原子半径 | 0.160nm | 0.143nm | 0.112nm | 0.104nm | 0.066nm |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 气态氢化物的还原性为H2T>H2R | B. | L2+与R2-的核外电子数相等 | ||
| C. | M与T形成的化合物不具有两性 | D. | 单质与稀盐酸反应的速率为L<Q |
分析 短周期元素,由元素的化合价可知,R、T都有-2价,处于ⅥA族,而R有+6价且原子半径较大,则T为O元素,R为S元素;L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg元素,Q为Be元素,M有+3价,处于ⅢA族,原子半径M的介于L、Q之间,则M为Al元素.
A.非金属性越强,气态氢化物越稳定;
B.核外电子数=质子数-离子带的电荷;
C.氧化铝能与酸反应生成相应的盐与水,与碱反应生成相应的盐与水;
D.金属性越强,与酸反应越剧烈.
解答 解:短周期元素,由元素的化合价可知,R、T都有-2价,处于ⅥA族,而R有+6价且原子半径较大,则T为O元素,R为S元素;L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg元素,Q为Be元素,M有+3价,处于ⅢA族,原子半径M的介于L、Q之间,则M为Al元素.
A.非金属性O>S,非金属性越强,氢化物越稳定,所以氢化物的稳定性为H2O>H2S,故A错误;
B.Mg2+核外有10个电子,S2-核外有18个电子,二者核外电子数不同,故B错误;
C.M与T形成的化合物是氧化铝,氧化铝是两性氧化物,溶于强酸、强碱,故C错误;
D.金属性Mg>Be,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为L>Q,故D错误.
故选:A.
点评 本题考查元素位置结构和性质的关系及应用,题目难度中等,根据元素化合价、原子半径推断元素是解答该题的关键,注意元素周期律的递变规律的应用.

练习册系列答案
相关题目
7.在N2+3H2 $?_{高温高压}^{催化剂}$ 2NH3的反应中,在5s中NH3的浓度变化了8mol/L.则NH3的平均反应速率( )
| A. | 2.4 mol/(L•s) | B. | 0.8mol/(L•s) | C. | 1.6 mol/(L•s) | D. | 0.08 mol/(L•s) |
5.美国科学家宣布发现了铝的“超级原子”结构--Al13和Al14,已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态,下列说法中,正确的是( )
| A. | Al13和Al14互为同位素 | |
| B. | Al14与盐酸反应的化学方程式可表示为:Al14+2HCl=Al14Cl2+H2↑ | |
| C. | Al13和Al14都具有较强的还原性,容易失去电子生成阳离子 | |
| D. | Al13超原子中Al原子间通过离子键结合 |
2.下列有关概念或原理的叙述正确的是 ( )
| A. | 氨基酸、蛋白质和氧化铝一样既能与酸反应,又能与碱反应,所以它们都是两性氧化物 | |
| B. | 制造婴儿用的一次性纸尿片采用的吸水保水的材料可以是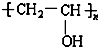 | |
| C. | 乙烯和聚乙烯都能使酸性KMnO4溶液褪色 | |
| D. | 甲酸乙酯、葡萄糖、麦芽糖、淀粉这四种物质的共同性质是,它们既可以发生水解反应,又可以发生银镜反应 |
6.下列说法正确的是( )
| A. | 烟、云、雾不属于胶体分散系 | |
| B. | 胶体和溶液可以用萃取的方法进行分离 | |
| C. | 用过滤的方法可以将NaCl从Fe(OH)3胶体和NaCl混和物中分离出来 | |
| D. | 用丁达尔效应可以区分胶体和溶液 |
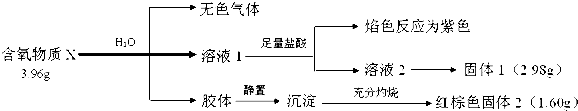

 <
<  (填“>”“<”或“=”,下同)
(填“>”“<”或“=”,下同)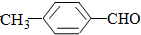 <
<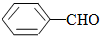
 >CH3COOH(提示:类比酚与醇的酸性)
>CH3COOH(提示:类比酚与醇的酸性) ;
; +nHCHO
+nHCHO 
 +nH2O.
+nH2O.