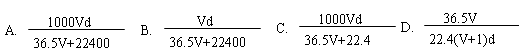题目内容
(6分)、现有Na2CO3、NaHCO3、NaOH的固体混合物共27.2g,将固体完全溶于水配成溶液后,向该溶液中逐滴加入1mol/L的盐酸。所加入盐酸溶液的体积与产生的CO2气体体积的关系如图所示:
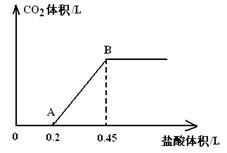
(1)写出OA段所发生反应的离子方程式 ;
(2)B点所产生的CO2的体积是_____________L(标准状况);
(3)原混合物中NaOH的质量为_____________g。

(1)写出OA段所发生反应的离子方程式 ;
(2)B点所产生的CO2的体积是_____________L(标准状况);
(3)原混合物中NaOH的质量为_____________g。
(1)CO32-+H+=HCO3- (2)5.6 (3)4.0
混合物溶于水后就发生:HCO3-+OH-=CO32-+H2O,溶液中的溶质有三种可能:①Na2CO3和NaHCO3②Na2CO3和NaOH③Na2CO3
若是①,随着向溶液中滴加盐酸:CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,则OA段与AB段所消耗盐酸的量后者大(符合题意)
若是②,随着向溶液中滴加盐酸:OH-+H+=H2O、CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,则OA段与AB段所消耗盐酸的量胶者大(不符合题意)
若是③,随着向溶液中滴加盐酸: CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,则OA段与AB段所消耗盐酸的量胶者相等(不符合题意)
设Na2CO3、NaHCO3、NaOH的物质的量分别为xmol、ymol、zmol
则:106x+84y+40z=27.2 x+z=0.2×1 x+y=0.25×1
解得:x="0.1" mol y="0.15" mol z=0.1mol
B点所产生的CO2的体积即:0.25×22.4=5.6L
原混合物中NaOH的质量为:0.1×40=4.0g
若是①,随着向溶液中滴加盐酸:CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,则OA段与AB段所消耗盐酸的量后者大(符合题意)
若是②,随着向溶液中滴加盐酸:OH-+H+=H2O、CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,则OA段与AB段所消耗盐酸的量胶者大(不符合题意)
若是③,随着向溶液中滴加盐酸: CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,则OA段与AB段所消耗盐酸的量胶者相等(不符合题意)
设Na2CO3、NaHCO3、NaOH的物质的量分别为xmol、ymol、zmol
则:106x+84y+40z=27.2 x+z=0.2×1 x+y=0.25×1
解得:x="0.1" mol y="0.15" mol z=0.1mol
B点所产生的CO2的体积即:0.25×22.4=5.6L
原混合物中NaOH的质量为:0.1×40=4.0g

练习册系列答案
相关题目