题目内容
恒温恒压下,在一个容积可变的密闭容器中发生反应:A(g)+B(g)?C(g),若开始时通入1mol A和1mol B,达到平衡时生成a mol C.则下列说法错误的是( )
分析:A.恒温恒压下,开始时通入3 molA和3mol B与开始时通入1molA和1molB,A与B的物质的量之比都是1:1,为等效平衡,反应物的转化率相同;
B.根据反应进行的方向分析,反应进行的方向不能确定;
C.若开始时通入2molA、2molB和1molC,达到平衡时,再通入3molC,等效为开始通入6molA、6molB,与开始时通入1molA和1molB为等效平衡,C的含量相同;
D.若在原平衡体系中,再通入1molA和1molB,等效为开始时通入2molA、2molB,与原平衡为等效平衡,平衡时各组分的含量不变.
B.根据反应进行的方向分析,反应进行的方向不能确定;
C.若开始时通入2molA、2molB和1molC,达到平衡时,再通入3molC,等效为开始通入6molA、6molB,与开始时通入1molA和1molB为等效平衡,C的含量相同;
D.若在原平衡体系中,再通入1molA和1molB,等效为开始时通入2molA、2molB,与原平衡为等效平衡,平衡时各组分的含量不变.
解答:解:A.恒温恒压下,开始时通入3 molA和3mol B与开始时通入1molA和1molB,A与B的物质的量之比都是1:1,为等效平衡,反应物的转化率相同,故达到平衡时,生成的C的物质的量为3amol,故A正确;
B.开始时通入4 mol A、4 mol B和2 mol C,可能处于平衡状态,可能向正反应进行,可能向逆反应进行,故达到平衡时,B的物质的量可能等于、小于或大于4 mol,故B错误;
C.若开始时通入2molA、2molB和1molC,达到平衡时,再通入3molC,等效为开始通入6molA、6molB,与开始时通入1molA和1molB为等效平衡,C的含量相同,由A(g)+B(g)?C(g)可知,生成amolC,混合气体总物质的量减少amol,故C的物质的量分数为
,故C正确;
D.若在原平衡体系中,再通入1molA和1molB,等效为开始时通入2molA、2molB,与原平衡为等效平衡,平衡时各组分的含量不变,混合气体的平均相对分子质量不变,故D正确;
故选B.
B.开始时通入4 mol A、4 mol B和2 mol C,可能处于平衡状态,可能向正反应进行,可能向逆反应进行,故达到平衡时,B的物质的量可能等于、小于或大于4 mol,故B错误;
C.若开始时通入2molA、2molB和1molC,达到平衡时,再通入3molC,等效为开始通入6molA、6molB,与开始时通入1molA和1molB为等效平衡,C的含量相同,由A(g)+B(g)?C(g)可知,生成amolC,混合气体总物质的量减少amol,故C的物质的量分数为
| a |
| 2-a |
D.若在原平衡体系中,再通入1molA和1molB,等效为开始时通入2molA、2molB,与原平衡为等效平衡,平衡时各组分的含量不变,混合气体的平均相对分子质量不变,故D正确;
故选B.
点评:本题考查化学平衡计算、等效平衡,难度中等,注意理解在恒温、恒压下,改变起始时加入物质的物质的量,只要按化学计量数换算成同一半边的物质的物质的量之比与原平衡相同,则达平衡后与原平衡等效.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
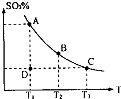 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题: 2SO3(g) △H=-197 kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。
2SO3(g) △H=-197 kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。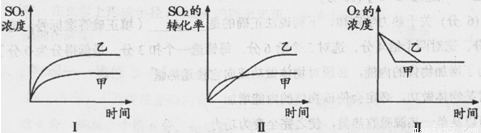
 ,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
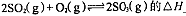 0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度
(填“增大”、“减小”或“不变”)。
0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度
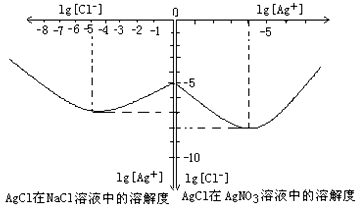
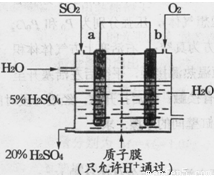
(填“增大”、“减小”或“不变”)。 是水的离子积),则这两种溶液可为 (填字母)。
是水的离子积),则这两种溶液可为 (填字母)。 2SO3(g) △H=-196.6 kJ·mol-1
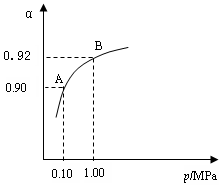
2SO3(g) △H=-196.6 kJ·mol-1 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。