题目内容
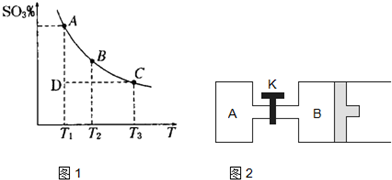
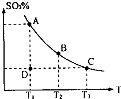 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:①反应2SO2(g)+O2(g)?2SO2(g)的△H
②若温度为T1、T2,反应的平衡常数分别为K1K2 则K1
③在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,在500℃开始反应,半分钟达到平衡,测得容器内含SO3 0.18mol,则v(O2)=
(2)已知三种无色溶液:a.NaHCO3溶液,b.AlCl3溶液,c.NaAlO2溶液,它们两两反应均能生成Al(OH)3沉淀.请回答下列问题:
①两种溶液恰好完全反应,所得溶液中c(OH-)=
| Kw |
②能体现出NaHCO3在反应中,HCO-3的水解程度小于电离程度的离于方程式为
分析:(1)①由图象可知反应混合体系SO3的百分含量随温度升高而减小,据此分析;压强随气体物质的量的增大而增大;根据浓度对平衡的影响分析;根据压强对平衡的影响分析;
②根据温度对平衡的影响分析K的大小;根据反应进行的程度分析;
③化学反应速率的定义求出氧气的速率;根据影响化学平衡的因素来判断平衡移动方向,利用极限法求出再次达平衡后n(SO3)的范围;
(2)①两种溶液恰好完全反应,所得溶液中c(OH-)=
,说明溶液为中性,依此判断;
②HCO-3的水解程度小于电离程度,则NaHCO3溶液中HCO-3电离生成CO32-,所以反应后会生成CO32-.
②根据温度对平衡的影响分析K的大小;根据反应进行的程度分析;
③化学反应速率的定义求出氧气的速率;根据影响化学平衡的因素来判断平衡移动方向,利用极限法求出再次达平衡后n(SO3)的范围;
(2)①两种溶液恰好完全反应,所得溶液中c(OH-)=
| Kw |
②HCO-3的水解程度小于电离程度,则NaHCO3溶液中HCO-3电离生成CO32-,所以反应后会生成CO32-.
解答:解:(1)①由图象可知反应混合体系SO3的百分含量随温度升高而减小,即升高温度平衡逆向移动,所以正方向为放热反应,△<0;压强随气体物质的量的增大而增大,通入SO3气体,气体总物质的量增大压强增大;若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通入大量氮气后,由于压强不变,容器的体积增大,反应物所占分压减小,则平衡向逆方向移动,所以SO2的物质的量增大,O2的物质的量也增大,由于体积增大所以O2的物质的量浓度减小;
故答案为:<;增大;逆反应方向;增大;减小;
②由图象可知T1<T2,已知△<0,所以升高温度平衡逆向移动,K减小,即K1>K2;由图象可知反应进行到D点时为达到平衡状态,所以反应向正方向进行,
则V正>V逆;
故答案为:>;>;
③当生成0.18molSO3时,参加反应的氧气的物质的量为x,
2SO2(g)+O2(g)?2SO2(g),
1 2
x 0.18mol
=
则x=0.09mol
v(O2)=
=0.036mol.L-1?min-1;
继续通入0.20mol SO2和0.10mol O2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;
用极限法求出n(SO3)的范围,
假设平衡不移动,此时n(SO3)=0.18×2=0.36mol,
假设0.40molSO2完全生成SO3,根据化学方程式2SO2+O2?2SO3 可知n(SO3)=0.4mol,
所以再次达到平衡时,0.36mol<n(SO3)<0.40mol;
故答案为:0.036;0.3 0.4;
(2)①两种溶液恰好完全反应,所得溶液中c(OH-)=
,即c(OH-)=c(H+),说明溶液为中性,NaHCO3溶液与AlCl3溶液反应生成为:3NaHCO3+AlCl3=Al(OH)3↓+3CO2↑+3NaCl,二氧化碳溶于水显弱酸性;NaHCO3溶液与NaAlO2溶液反应为:NaHCO3+NaAlO2+H2O=Al(OH)3↓+Na2CO3,溶液显碱性;AlCl3溶液与NaAlO2溶液反应为:3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl,溶液显中性,所以符合题意的溶液为b c;
故答案为:b c;
②HCO-3的水解程度小于电离程度,则NaHCO3溶液中HCO-3电离生成CO32-,所以反应后会生成CO32-;已知NaHCO3溶液与NaAlO2溶液反应为:NaHCO3+NaAlO2+H2O=Al(OH)3↓+Na2CO3,其离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-,则该反应能体现出NaHCO3在反应中HCO-3的水解程度小于电离程度,
故答案为:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-.
故答案为:<;增大;逆反应方向;增大;减小;
②由图象可知T1<T2,已知△<0,所以升高温度平衡逆向移动,K减小,即K1>K2;由图象可知反应进行到D点时为达到平衡状态,所以反应向正方向进行,
则V正>V逆;
故答案为:>;>;
③当生成0.18molSO3时,参加反应的氧气的物质的量为x,
2SO2(g)+O2(g)?2SO2(g),
1 2
x 0.18mol
| 1 |
| 2 |
| x |
| 0.18 |
v(O2)=
| 0.09mol |
| 5L?0.5min |
继续通入0.20mol SO2和0.10mol O2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;
用极限法求出n(SO3)的范围,
假设平衡不移动,此时n(SO3)=0.18×2=0.36mol,
假设0.40molSO2完全生成SO3,根据化学方程式2SO2+O2?2SO3 可知n(SO3)=0.4mol,
所以再次达到平衡时,0.36mol<n(SO3)<0.40mol;
故答案为:0.036;0.3 0.4;
(2)①两种溶液恰好完全反应,所得溶液中c(OH-)=
| Kw |
故答案为:b c;
②HCO-3的水解程度小于电离程度,则NaHCO3溶液中HCO-3电离生成CO32-,所以反应后会生成CO32-;已知NaHCO3溶液与NaAlO2溶液反应为:NaHCO3+NaAlO2+H2O=Al(OH)3↓+Na2CO3,其离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-,则该反应能体现出NaHCO3在反应中HCO-3的水解程度小于电离程度,
故答案为:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-.
点评:本题考查了平衡移动及影响因素,平衡常数的应用,溶液中离子之间的反应等,题目涉及的内容较多,考查角度广,难度较大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
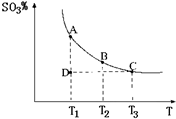 (2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义. 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
 ,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
 0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度
(填“增大”、“减小”或“不变”)。
0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度
(填“增大”、“减小”或“不变”)。 是水的离子积),则这两种溶液可为 (填字母)。
是水的离子积),则这两种溶液可为 (填字母)。