题目内容
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为: ,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:

①反应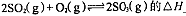 0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度
(填“增大”、“减小”或“不变”)。
0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度
(填“增大”、“减小”或“不变”)。
②若温度为T1、 T2,反应的平衡常数分别为K1、K2 则K1 K2(填“>”、“<”或“=”),反应进行到D点状态时,V正 V逆(填“>”、“<”或“=”)
③在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10 mol O2,在500℃开始反应,半分钟达到平衡,测得容器内含SO3 0.18 mol,则v(O2)= mol·L-1·min-1,若继续通入0.20 mol SO2和0.10 mol O2,平衡发生了移动,再次达到平衡后, mol<n(SO3)< mol.
(2)已知三种无色溶液:a.NaHCO3溶液,b.AlCl3溶液,c.NaAlO2溶液,它们两两反应均能生成Al(OH)3沉淀。请回答下列问题:
①两种溶液恰好完全反应,所得溶液中c(OH—)= 是水的离子积),则这两种溶液可为 (填字母)。
是水的离子积),则这两种溶液可为 (填字母)。
②能体现出NaHCO3在反应中,HCO—3的水解程度小于电离程度的离于方程式为 。
(1)①< 增大 逆反应方向 增大 减小
②> > ③0.036 0.36 0.40
(2)①b c②HCO3-+AlO2-+H2O=Al(OH)3+CO32-
【解析】(1)①升高温度,平衡向吸热反应方向移动。升高温度,SO3的百分含量减小,逆反应是吸热反应,则正反应是放热反应,
△H<0;再通入SO3,体系压强增大,又要重新达到平衡,平衡应该向逆反应方向移动;恒温恒压下,通入惰性气体,体系容积扩大,相当于压强减小,平衡向逆反应方向移动,SO2的物质的量增大,O2的浓度减小。②此反应正反应是放热反应,低温有利于平衡向正反应方向移动。而平衡常数是生成物浓度幂之积比反应物浓度幂之积,T2>T1,故K1>K2。D点不是平衡点,要达到平衡,SO3的百分含量要增大,故V正>V逆。③
2SO2+
O2 2SO3
2SO3
起始:0.20 0.10 0
转化:0.18 0.09 0.18
平衡:0.20-0.18 0.10-0.09 0.18
v(O2)=0.09/5/0.5=0.036mol·L-1·min-1
可逆反应不能进行到底,故0.36mol<n(SO3)<0.40mol
(2)①“两种溶液恰好完全反应,所得溶液中c(OH—)=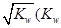 是水的离子积)”,说明反应后溶液呈中性,只能是AlCl3和NaAlO2混合;②NaHCO3与NaAlO2混合溶液呈碱性,说明HCO3-的水解程度小于电离程度。
是水的离子积)”,说明反应后溶液呈中性,只能是AlCl3和NaAlO2混合;②NaHCO3与NaAlO2混合溶液呈碱性,说明HCO3-的水解程度小于电离程度。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案 (2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义. 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题: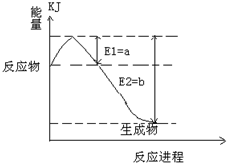
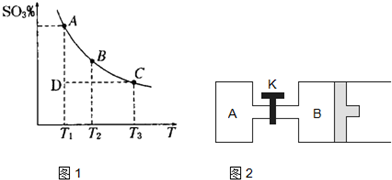
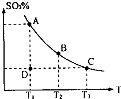 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题: