题目内容
【题目】为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物,并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究。
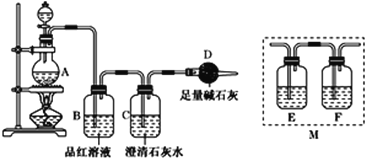
(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下碳与浓硫酸不反应;②______________。
(2)点燃酒精灯,反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是______________。
(3)装置B的作用是___________。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。装置A中能产生二氧化碳的化学方程式为______。
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B和C之间添加装置M。装置E、F中盛放的试剂分别是____________、____________。重新实验后观察到装置F中的现象是________。
【答案】常温下Fe在浓硫酸中发生钝化 铁、碳在硫酸溶液中形成原电池 检验SO2的存在 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 酸性KMnO4溶液或溴水(或其他合理答案) 品红溶液 品红溶液不褪色或无明显现象
CO2↑+2SO2↑+2H2O 酸性KMnO4溶液或溴水(或其他合理答案) 品红溶液 品红溶液不褪色或无明显现象
【解析】
(1)常温下Fe在浓硫酸中表面生成一层致密的氧化膜,即发生钝化,故答案为:常温下Fe在浓硫酸中发生钝化。
(2)反应一段时间后,浓硫酸变成稀硫酸,铁、碳和稀硫酸发生原电池反应,故答案为:铁、碳在硫酸溶液中形成原电池。
(3)装置B的作用是检验SO2的生成,如果有SO2的生成,可以观察到品红溶液褪色,故答案为:检验SO2的存在。
(4)碳与浓硫酸在加热条件下反应生成二氧化碳和二氧化硫,反应方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(5)二氧化硫也能使澄清石灰水变浑浊,因此需要用E除去二氧化碳中的二氧化硫,用F检验二氧化硫已被完全除去,故E中有酸性高锰酸钾溶液或溴水等可以与二氧化硫反应且不与二氧化碳反应的溶液,F中有品红溶液,若观察到品红溶液不褪色,则二氧化硫被完全除去,故答案为:酸性KMnO4溶液或溴水(或其他合理答案);品红溶液;品红溶液不褪色或无明显现象。

 名题金卷系列答案
名题金卷系列答案