题目内容
在一密闭容器中,反应2SO2(g)+O2(g)═2SO3(g)+Q(Q>0)达到平衡.完成下列填空:
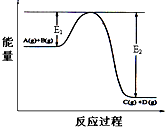
(1)升高温度,平衡向______方向移动(选填“正反应”或“逆反应”).在工业生产中反应温度控制在400~500℃,主要是因为______.
(2)欲使SO2转化率增大,可采取的措施有______、______.
(3)若容器容积为2L,开始加入的SO2为0.1mol,20s后测得SO3的物质的量为0.08mol,则O2的平均反应速率为______mol/(L?s).
(1)升高温度,平衡向______方向移动(选填“正反应”或“逆反应”).在工业生产中反应温度控制在400~500℃,主要是因为______.
(2)欲使SO2转化率增大,可采取的措施有______、______.
(3)若容器容积为2L,开始加入的SO2为0.1mol,20s后测得SO3的物质的量为0.08mol,则O2的平均反应速率为______mol/(L?s).
(1)该反应为放热反应,则升高温度,平衡向逆反应方向移动;生产中反应温度控制在400~500℃,是因该温度下催化剂活性最大,
故答案为:逆反应;
(2)欲使SO2转化率增大,可使平衡正向移动,采取措施为加压、通入氧气等,故答案为:加压;通入氧气;
(3)20s后测得SO3的物质的量为0.08mol,则v(SO3)=
=0.002mol/(L?s),由反应速率之比等于化学计量数之比可知,v(O2)=
×v(SO3)=
×0.002mol/(L?s)=0.001mol/(L?s),故答案为:0.001.
故答案为:逆反应;
(2)欲使SO2转化率增大,可使平衡正向移动,采取措施为加压、通入氧气等,故答案为:加压;通入氧气;
(3)20s后测得SO3的物质的量为0.08mol,则v(SO3)=
| ||
| 20s |
| 1 |
| 2 |
| 1 |
| 2 |

练习册系列答案
相关题目