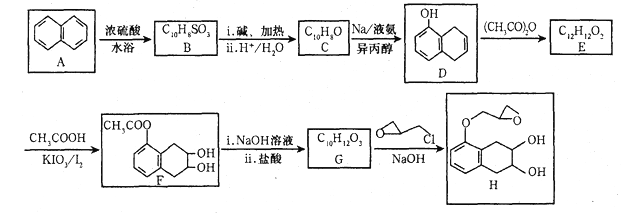
题目内容
【题目】下列说法错误的是( )
A. PH4+、 PO43-、XeO4 的空间构型均为正四面体形
B. CO32-、 NO3-、CH2O的空间构型均为平面三角形
C. NH2-、NF3、Cl2O、 I3- 的VSEPR 模型名称均为四面体形
D. 微粒 N2H5、 NH4 、Fe(CO)3、Fe(SCN)3、H3O+、[Ag(NH3)2]OH 中均含有配位键
【答案】C
【解析】
A.PH4+的价层电子对数=5-1+(5-1-4![]() 1)/2=4,为正四面体形,PH4+、 PO43-、XeO4三种微粒都没有故对电子,原子数相等,所以结构相同都为正四面体形,故A正确;B. CO32-的价层电子对数=3+(4+2-3
1)/2=4,为正四面体形,PH4+、 PO43-、XeO4三种微粒都没有故对电子,原子数相等,所以结构相同都为正四面体形,故A正确;B. CO32-的价层电子对数=3+(4+2-3![]() )=3,因为没有故对电子,所以CO32-为平面三角形 ,同理NO3-、CH2O与的CO32-类似,结构相同,空间构型均为平面三角形,故B正确;C. NH2-的价层电子对数=1+(5+1-2
)=3,因为没有故对电子,所以CO32-为平面三角形 ,同理NO3-、CH2O与的CO32-类似,结构相同,空间构型均为平面三角形,故B正确;C. NH2-的价层电子对数=1+(5+1-2![]() )/2=3,含有一对孤对电子,所以NH2-为V形;NF3的价层电子对数=1+(5-3
)/2=3,含有一对孤对电子,所以NH2-为V形;NF3的价层电子对数=1+(5-3![]() )/2=3没有孤对电子,为平面三角形;Cl2O的价层电子对数=2+(6-2
)/2=3没有孤对电子,为平面三角形;Cl2O的价层电子对数=2+(6-2![]() )/2=4,含有两对孤对电子、 I3-的价层电子对数=(7+1)/2=4的VSEPR 模型名称为四面体形;故C错;D. 氨气分子中氮原子含有孤电子对,氢离子提供空轨道,所以N2H5、 NH4 可形成配位键; Fe(CO)3、Fe(SCN)3、Fe(CO)3、Fe(SCN)3中(CO)3(SCN)3分别给出孤对电子,Fe3+接受孤对电子,所以Fe(CO)3、Fe(SCN)3也为配合物,含有配位键;H3O+中氧有孤对电子,H+有空轨道,所以H3O+含有配位键;[Ag(NH3)2]OH 中NH3有孤对电子,Ag+接受孤对电子形成配位键;故D对;答案:C。
)/2=4,含有两对孤对电子、 I3-的价层电子对数=(7+1)/2=4的VSEPR 模型名称为四面体形;故C错;D. 氨气分子中氮原子含有孤电子对,氢离子提供空轨道,所以N2H5、 NH4 可形成配位键; Fe(CO)3、Fe(SCN)3、Fe(CO)3、Fe(SCN)3中(CO)3(SCN)3分别给出孤对电子,Fe3+接受孤对电子,所以Fe(CO)3、Fe(SCN)3也为配合物,含有配位键;H3O+中氧有孤对电子,H+有空轨道,所以H3O+含有配位键;[Ag(NH3)2]OH 中NH3有孤对电子,Ag+接受孤对电子形成配位键;故D对;答案:C。