题目内容
下表是元素周期表短周期的一部分
(1)①-⑦元素中金属性最强的元素位于周期表第 周期 族.
(2)可作为半导体材料的是 (写元素符号).
(3)表中元素⑥的原子结构示意图为 .
(4)④与⑤形成的常见化合物的化学键的类型为 ,该化合物的电子式为 .
(5)表中元素①、②、③、⑤、⑦中,原子半径由大到小的顺序是 (填数字序号)
(6)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为 .
| ① | ||||||||
| ② | ③ | ④ | ||||||
| ⑤ | ⑥ | ⑦ | ||||||
(2)可作为半导体材料的是
(3)表中元素⑥的原子结构示意图为
(4)④与⑤形成的常见化合物的化学键的类型为
(5)表中元素①、②、③、⑤、⑦中,原子半径由大到小的顺序是
(6)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中位置知,①为H、②为C、③为N、④为F、⑤为Mg、⑥为Al、⑦为Si.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强;
(2)Si可作半导体材料;
(3)Al元素原子核外有13个电子,各层电子数为2、8、3;
(4)④与⑤形成的常见化合物为MgF2,由镁离子与氟离子构成;
(5)同同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中H原子半径最小;
(6)元素③、⑥它们最高价氧化物的水化物分别为硝酸、氢氧化铝,二者反应生成硝酸铝与水.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强;
(2)Si可作半导体材料;
(3)Al元素原子核外有13个电子,各层电子数为2、8、3;
(4)④与⑤形成的常见化合物为MgF2,由镁离子与氟离子构成;
(5)同同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中H原子半径最小;
(6)元素③、⑥它们最高价氧化物的水化物分别为硝酸、氢氧化铝,二者反应生成硝酸铝与水.
解答:
解:根据元素在周期表中位置知,①为H、②为C、③为N、④为F、⑤为Na、⑥为Al、⑦为Si.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故上述元素中Mg的金属性最强,处于第三周期ⅡA族,故答案为:三、ⅡA;
(2)Si可作半导体材料,故答案为:Si;
(3)Al元素原子核外有13个电子,各层电子数为2、8、3,原子结构示意图为: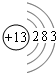 ,故答案为:
,故答案为: ;
;
(4)④与⑤形成的常见化合物为MgF2,由镁离子与氟离子构成,含有离子键,其电子式为: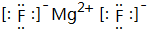 ,
,
故答案为:离子键;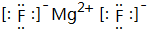 ;
;
(5)同同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中H原子半径最小,故原子半径:⑤>⑦>②>③>①,故答案为:⑤>⑦>②>③>①;
(6)元素③、⑥它们最高价氧化物的水化物分别为硝酸、氢氧化铝,二者反应生成硝酸铝与水,反应离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故上述元素中Mg的金属性最强,处于第三周期ⅡA族,故答案为:三、ⅡA;
(2)Si可作半导体材料,故答案为:Si;
(3)Al元素原子核外有13个电子,各层电子数为2、8、3,原子结构示意图为:
 ,故答案为:
,故答案为: ;
;(4)④与⑤形成的常见化合物为MgF2,由镁离子与氟离子构成,含有离子键,其电子式为:
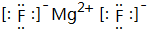 ,
,故答案为:离子键;
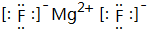 ;
;(5)同同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中H原子半径最小,故原子半径:⑤>⑦>②>③>①,故答案为:⑤>⑦>②>③>①;
(6)元素③、⑥它们最高价氧化物的水化物分别为硝酸、氢氧化铝,二者反应生成硝酸铝与水,反应离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O.
点评:本题考查元素周期表与元素周期律综合应用,比较基础,注意整体把握元素周期表,掌握电子式的书写、微粒半径大小比较.

练习册系列答案
相关题目
下列各组物质的溶液不用其它试剂就可鉴别的是( )
| A、FeCl3 HCl NaCl NaOH |
| B、BaCl2 Na2CO3 HCl (NH4)2CO3 |
| C、HCl CuCl2 NaNO3 Na2SO4 |
| D、Na2CO3 Na2SO4 HCl H2SO4 |
下列叙述中不正确的是( )
| A、卤化氢分子中,卤素的非金属性越强,共价键的极性越强,分子越稳定 |
| B、以极性键结合的分子,不一定是极性分子 |
| C、判断A2B或AB2型分子是极性分子的依据是:具有极性键且分子构型不对称、键角小于180°的非直线形结构 |
| D、非极性分子中,各原子间都应以非极性键结合 |
 Ⅰ.自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.
Ⅰ.自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.