题目内容
尿素[CO(NH2)2]是首个由无机物人工合成的有机物。工业上合成尿素的反应如下:
![]() 。回答下列问题:
。回答下列问题:
(1)已知工业上合成尿素分两步进行,相关反应如下:
![]()
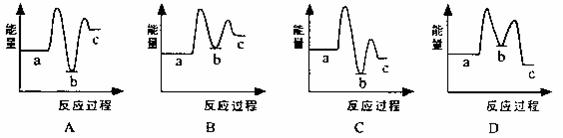
下列示意图中[a表示2NH3(g)+CO2(g),b表示NH2COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号) 。
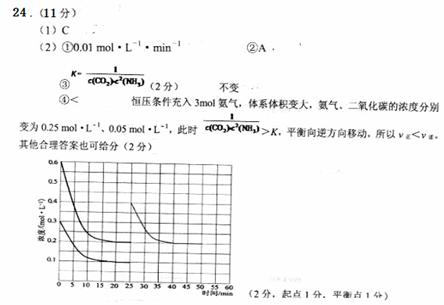
 (2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。
①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为 。
②为提高尿素的产率,下列可以采取的措施有 。
A.缩小反应容器的容积 B.升高温度
C.平衡体系中及时分离出CO(NH2)2 D.使用合适的催化剂
③该反应的平衡常数表达式K= ;若升高体系的温度,容器中NH3的体积分数将 (填“增加”、“减小”或“不变”)。
④若保持平衡的温度和压强不变,再向容器中充入3mol的氨气,则此时v正 v逆(填“>”“=”或“<”),判断理由 。
⑤若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在上图中画出25~50min内氨气的浓度变化曲线。
练习册系列答案
相关题目



 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 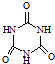 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过 绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.
绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.