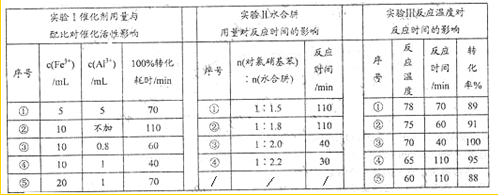
题目内容
Ⅰ.用尿素、氢氧化钠和水作为溶剂,预冷至零下12℃,能将极难溶解的纤维素溶化为粘液.武汉大学张俐娜教授因此而荣获美国2011年度安塞姆?佩恩奖.
(1)尿素[CO(NH2)2]中元素原子半径最大的原子结构示意图为 ;能说明氧元素原子比氮元素原子得电子能力强的事实是 (填选项).
A.在NO2中氧元素显负价,氮元素显正价
B.H2O的热稳定性比NH3的稳定
C.常温下H2O是液态而NH3是气态
D.O2比N2易液化
(2)尿素在土壤中的脲酶作用下会水解生成碳酸铵或碳酸氢铵,若与碱性肥料混合施用,会造成氮元素损失,请用离子方程式解释其原因 ;
已知:20℃时,H2CO3:Ka1=4.2×10-7;Ka2=5.6×10-11;NH3?H2O:Kb=1.7×10-5
碳酸氢铵溶液中HCO-3、NH+4,OH-、H+四种离子浓度由大到小是 (填选项).
A.c(HCO3-)c(NH4+)c(OH-)c(H+)
B.c(NH4+)c(HCO3-)c(OH-)c(H+)
C.c(HCO3-)c(NH4+)c(H+)c(OH-)
D.c(NH4+)c(HCO3-)c(H+)c(OH-)
Ⅱ.NaNO2外观酷似食盐,误食会中毒.
(3)在酸性条件下,NaNO2与KI按物质的量1:1恰好完全反应,I-被氧化为I2.写出此反应的离子方程式 .
(4)工业废水中含少量NO-2,可用电解法将NO-2转换为N2除去.N2将在 极生成,写出NO-2在酸性条件下转化为N2的电极反应式 .
(1)尿素[CO(NH2)2]中元素原子半径最大的原子结构示意图为
A.在NO2中氧元素显负价,氮元素显正价
B.H2O的热稳定性比NH3的稳定
C.常温下H2O是液态而NH3是气态
D.O2比N2易液化
(2)尿素在土壤中的脲酶作用下会水解生成碳酸铵或碳酸氢铵,若与碱性肥料混合施用,会造成氮元素损失,请用离子方程式解释其原因
已知:20℃时,H2CO3:Ka1=4.2×10-7;Ka2=5.6×10-11;NH3?H2O:Kb=1.7×10-5
碳酸氢铵溶液中HCO-3、NH+4,OH-、H+四种离子浓度由大到小是
A.c(HCO3-)c(NH4+)c(OH-)c(H+)
B.c(NH4+)c(HCO3-)c(OH-)c(H+)
C.c(HCO3-)c(NH4+)c(H+)c(OH-)
D.c(NH4+)c(HCO3-)c(H+)c(OH-)
Ⅱ.NaNO2外观酷似食盐,误食会中毒.
(3)在酸性条件下,NaNO2与KI按物质的量1:1恰好完全反应,I-被氧化为I2.写出此反应的离子方程式
(4)工业废水中含少量NO-2,可用电解法将NO-2转换为N2除去.N2将在
分析:I.(1)原子的电子层数越多,其原子半径越大,相同周期的元素中,原子半径随着原子序数的增大而减小;非金属的非金属性越强,其氢化物越稳定、其最高价氧化物的水化物酸性越强、单质的氧化性越强等;
(2)碱性条件下,铵根离子和氢氧根离子反应生成一水合氨,一水合氨不稳定易分解生成氨气和水;
电离平衡常数越大,其电离程度越大,则其离子水解程度越小;
II.(3)酸性条件下,NaNO2与KI按物质的量1:1恰好完全反应,I-被氧化为I2,则亚硝酸根离子被还原生成NO;
(4)电解时,得电子的微粒在阴极上发生还原反应,电解亚硝酸根离子溶液时,阴极上亚硝酸根离子得电子发生还原反应生成氮气和水.
(2)碱性条件下,铵根离子和氢氧根离子反应生成一水合氨,一水合氨不稳定易分解生成氨气和水;
电离平衡常数越大,其电离程度越大,则其离子水解程度越小;
II.(3)酸性条件下,NaNO2与KI按物质的量1:1恰好完全反应,I-被氧化为I2,则亚硝酸根离子被还原生成NO;
(4)电解时,得电子的微粒在阴极上发生还原反应,电解亚硝酸根离子溶液时,阴极上亚硝酸根离子得电子发生还原反应生成氮气和水.
解答:解:I.(1)原子的电子层数越多,其原子半径越大,相同周期的元素中,原子半径随着原子序数的增大而减小,所以原子半径最大的元素是C元素,其原子结构示意图为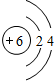 ;
;
非金属的非金属性越强,其氢化物越稳定、其最高价氧化物的水化物酸性越强、单质的氧化性越强等,
A.在NO2中氧元素显负价,氮元素显正价,说明氮气的氧化性小于氧气,则O元素的非极性大于N元素,故正确;
B.H2O的热稳定性比NH3的稳定,则O元素的非金属性大于N元素,故正确;
C.常温下H2O是液态而NH3是气态不能说明O元素的非金属性大于N元素,故错误;
D.O2比N2易液化不能说明O元素的非金属性大于N元素,故错误;
故选AB;
故答案为: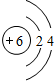 ;AB;
;AB;
(2)碱性条件下,铵根离子和氢氧根离子反应生成一水合氨,一水合氨不稳定易分解生成氨气和水,所以其离子方程式为:NH4++OH-=NH3.H2O=NH3↑+H2O;
电离平衡常数越大,其电离程度越大,则其离子水解程度越小,根据电离平衡常数知,电离程度大小关系是H2CO3>NH3?H2O>HCO3-,则水解程度CO32->NH4+>HCO3-,所以碳酸氢铵溶液中HCO-3、NH+4,OH-、H+四种离子浓度由大到小c(HCO3-)>c(NH4+)>c(OH-)>c(H+),故选B,
故答案为:NH4++OH-=NH3.H2O=NH3↑+H2O;B;
II.(3)酸性条件下,NaNO2与KI按物质的量1:1恰好完全反应,I-被氧化为I2,则亚硝酸根离子被还原生成NO,再结合原子守恒书写离子方程式,所以其离子方程式为 2NO2-+2I-+4H+=2NO↑+I2+2H2O,
故答案为:2NO2-+2I-+4H+=2NO↑+I2+2H2O;
(4)电解时,得电子的微粒在阴极上发生还原反应,电解亚硝酸根离子溶液时,阴极上亚硝酸根离子得电子发生还原反应生成氮气和水,电极反应式为2NO2-+8H++6e-=N2↑+4H2O,
故答案为:阴;2NO2-+8H++6e-=N2+4H2O.
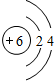 ;
;非金属的非金属性越强,其氢化物越稳定、其最高价氧化物的水化物酸性越强、单质的氧化性越强等,
A.在NO2中氧元素显负价,氮元素显正价,说明氮气的氧化性小于氧气,则O元素的非极性大于N元素,故正确;
B.H2O的热稳定性比NH3的稳定,则O元素的非金属性大于N元素,故正确;
C.常温下H2O是液态而NH3是气态不能说明O元素的非金属性大于N元素,故错误;
D.O2比N2易液化不能说明O元素的非金属性大于N元素,故错误;
故选AB;
故答案为:
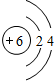 ;AB;
;AB;(2)碱性条件下,铵根离子和氢氧根离子反应生成一水合氨,一水合氨不稳定易分解生成氨气和水,所以其离子方程式为:NH4++OH-=NH3.H2O=NH3↑+H2O;
电离平衡常数越大,其电离程度越大,则其离子水解程度越小,根据电离平衡常数知,电离程度大小关系是H2CO3>NH3?H2O>HCO3-,则水解程度CO32->NH4+>HCO3-,所以碳酸氢铵溶液中HCO-3、NH+4,OH-、H+四种离子浓度由大到小c(HCO3-)>c(NH4+)>c(OH-)>c(H+),故选B,
故答案为:NH4++OH-=NH3.H2O=NH3↑+H2O;B;
II.(3)酸性条件下,NaNO2与KI按物质的量1:1恰好完全反应,I-被氧化为I2,则亚硝酸根离子被还原生成NO,再结合原子守恒书写离子方程式,所以其离子方程式为 2NO2-+2I-+4H+=2NO↑+I2+2H2O,
故答案为:2NO2-+2I-+4H+=2NO↑+I2+2H2O;
(4)电解时,得电子的微粒在阴极上发生还原反应,电解亚硝酸根离子溶液时,阴极上亚硝酸根离子得电子发生还原反应生成氮气和水,电极反应式为2NO2-+8H++6e-=N2↑+4H2O,
故答案为:阴;2NO2-+8H++6e-=N2+4H2O.
点评:本题考查了离子方程式的书写、电极反应式的书写、盐类水解等知识点,根据氧化还原反应中反应物和生成物来书写离子方程式,结合得失电子书写电极反应式,难点是离子浓度大小的比较,明确电离平衡常数与离子水解程度关系即可解答,难度中等.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
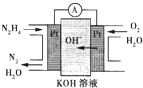 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列问题:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列问题: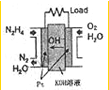 肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.度回答下列问题
肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.度回答下列问题