题目内容
14.某气体有机物在氧气中燃烧生成二氧化碳和水的实验事实说明( )| A. | 该有机物的分子式为CH4 | B. | 该有机物中含碳元素和氢元素 | ||
| C. | 该有机物中只含有碳元素和氢元素 | D. | 该有机物的化学性质比较稳定 |
分析 有机物在氧气中燃烧生成二氧化碳和水,由元素守恒可知,有机物一定含C、H元素,以此来解答.
解答 解:A.生成二氧化碳和水,可知一定含C、H元素,还可能含O元素,但不能确定分子构成,不一定为CH4,故A错误;
B.由元素守恒可知,有机物一定含C、H元素,故B正确;
C.反应物有氧气,不能确定有机物是否含氧元素,故C错误;
D.由上述选项可知,有机物可能为烷烃、烯烃及烃的含氧衍生物等,若为烷烃性质稳定,故D错误;
故选B.
点评 本题考查有机物的组成,为基础性习题,把握元素守恒为解答的关键,注意有机物中氧元素的判断需要定量计算确定,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列有关原子核外电子排布的说法正确的是( )
| A. | 原子核外的电子总是尽先排在能量高的电子层里,然后才排在能量低的电子层 | |
| B. | 某原子的核电荷数与最外层电子数相等 | |
| C. | 原子核外的电子层分为七层,每层所排的电子数相同 | |
| D. | 某原子M层上电子数是L层上电子数的4倍 |
5.A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:
试回答以下问题
(1)B在周期表中的位置是第二周期第ⅤA族,B的氢化物与E的氢化物比较,沸点较高的是NH3(填化学式).
(2)D3B可与水反应生成2种碱性物质,请写出这一化学方程式Na3N+3H2O=3NaOH+NH3↑.
(3)写出丙的电子式为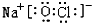 .丙在水溶液中的电离方程式NaClO=Na++ClO-.
.丙在水溶液中的电离方程式NaClO=Na++ClO-.
(4)由B、C、D三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈中性.将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成蓝色溶液,写出该反应的离子方程式3Cu+8H++2=3Cu2++2NO↑+4H2O.
| 元素 | A | B | C | D | E |
| 性质 或结 构信 息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,甲有强氧化性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E的气态氢化物和最高价氧化物对应的水化物均为强酸,C、D和E三种元素形成的一种盐丙为某消毒液的主要成分 |
(1)B在周期表中的位置是第二周期第ⅤA族,B的氢化物与E的氢化物比较,沸点较高的是NH3(填化学式).
(2)D3B可与水反应生成2种碱性物质,请写出这一化学方程式Na3N+3H2O=3NaOH+NH3↑.
(3)写出丙的电子式为
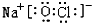 .丙在水溶液中的电离方程式NaClO=Na++ClO-.
.丙在水溶液中的电离方程式NaClO=Na++ClO-.(4)由B、C、D三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈中性.将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成蓝色溶液,写出该反应的离子方程式3Cu+8H++2=3Cu2++2NO↑+4H2O.
2.根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价] | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | L2+与R2-的核外电子数相等 | D. | M与T形成的化合物具有两性 |
9.只用一种试剂就能区别NaCl溶液、NaBr溶液、KI溶液、AgNO3溶液,该试剂是( )
| A. | 氯水 | B. | H2O | C. | 稀盐酸 | D. | NaOH溶液 |
6.根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
| A. | K层电子数为偶数的所有元素所在族的序数与该元素原子的K层电子数相等 | |
| B. | L层电子数为奇数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| C. | L层电子数为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| D. | M层电子数为偶数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
3.X和Y的原子序数都小于两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能是( )
| A. | n+11 | B. | n-5 | C. | n+3 | D. | n-6 |
4.镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中的总反应方程式是:Ni(OH)2+M=NiOOH+MH.已知:6NiOOH+NH3+H2O+OH-=6Ni(OH)2+NO2-,下列说法正确的是( )
| A. | NiMH 电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-=Ni(OH)2+OH- | |
| B. | 充电过程中OH-离子从阳极向阴极迁移 | |
| C. | 充电过程中阴极的电极反应式:H2O+M+e-=MH+OH-,H2O中的H被M还原 | |
| D. | 放电是OH-离子从正极向负极迁移 |
 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷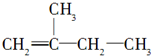 2-甲基-1丁烯
2-甲基-1丁烯 .
. .
. 分子式为C10H20,按碳的骨架分,该有机物属于ab.(填字母序号)
分子式为C10H20,按碳的骨架分,该有机物属于ab.(填字母序号)