题目内容
【题目】Ⅰ.2SO2(g)+O2(g)![]() 2SO3(g),反应过程的能量变化如图所示:
2SO3(g),反应过程的能量变化如图所示:
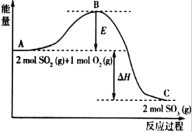
已知2mol SO2(g)和O2(g)反应生成为1mol SO3(g)的ΔΗ=-99kJ·mol-1,请回答下列问题。
(1)该反应通常用V2O5作催化剂,加V2O5会使图中B点_______ (填“升高”或“降低”)。
(2)图中ΔΗ= __________。
(3)如果反应速率v(SO2)为0.05mol·L-1·min-1,则v(O2)= _______。
Ⅱ.已知下列热化学方程式:
①H2O(l)===H2(g)+![]() O2(g)ΔH=+285.8 kJ/mol
O2(g)ΔH=+285.8 kJ/mol
②H2(g)+![]() O2(g)===H2O(g)ΔH=-241.8 kJ/mol
O2(g)===H2O(g)ΔH=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol
④C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
⑤C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于吸热反应的是___________;
(2)燃烧10 g H2生成液态水,放出的热量为__________;
(3)写出CO燃烧的热化学方程式__________;
(4)写出制水煤气的热化学方程式_____________。
【答案】降低 -198 kJ·mol-1 0.025 mol·L-1·min-1 ① 1429 kJ CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ/mol C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ/mol
O2(g)===CO2(g) ΔH=-283 kJ/mol C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ/mol
【解析】
I.由图可知,2SO2(g)+O2(g)=2SO3(g)为放热反应,加入催化剂,活化能减小,反应反应热不变,根据反应2SO2(g)+O2(g)=2SO3(g)结合1mol SO2氧化为1mol SO3的△H=-99kJmol-1计算反应热;
II.主要是盖斯定律的应用,先写出目标反应的方程式,再得出方程式的运算式,最后计算反应热。
I(1)因图中A、C分别表示反应物总能量、生成物总能量,E为活化能,活化能的大小与反应热无关,加入催化剂,活化能减小即E减小,故B点降低,故答案为:降低;
(2)因1mol SO2(g)氧化为1mol SO3的 △H=-99kJmol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJmol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJmol-1,故答案为:-198;
(3)速率之比等于计量数之比,v(SO2)为0.05mol·L-1·min-1,则v(O2)= 0.025 mol·L-1·min-1,故答案为:0.025 mol·L-1·min-1;
II(1)由△H>0时为吸热反应可知,②③④⑤为放热反应,①为吸热反应,故答案为:①;
(2)①H2O(l)===H2(g)+![]() O2(g)ΔH=+285.8 kJ/mol,则燃烧10gH2即5molH2时,放热为285.8kJ/mol×5mol=1429kJ,故答案为:1429kJ;
O2(g)ΔH=+285.8 kJ/mol,则燃烧10gH2即5molH2时,放热为285.8kJ/mol×5mol=1429kJ,故答案为:1429kJ;
(3)CO燃烧的化学方程式为:CO(g)+![]() O2(g)=CO2(g),
O2(g)=CO2(g),
④C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
⑤C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
由盖斯定律,⑤-④得CO(g)+![]() O2(g)=CO2(g),故ΔH=-393.5 kJ/mol-(-110.5 kJ/mol)=-283 kJ/mol,故答案为:CO(g)+
O2(g)=CO2(g),故ΔH=-393.5 kJ/mol-(-110.5 kJ/mol)=-283 kJ/mol,故答案为:CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ/mol;
O2(g)===CO2(g) ΔH=-283 kJ/mol;
(4)制水煤气的化学方程式C(s)+H2O(g)===CO(g)+H2(g),
②H2(g)+![]() O2(g)===H2O(g)ΔH=-241.8 kJ/mol
O2(g)===H2O(g)ΔH=-241.8 kJ/mol
④C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
由盖斯定律,④-②得C(s)+H2O(g)===CO(g)+H2(g),故ΔH=-110.5 kJ/mol-(-241.8 kJ/mol)=+131.3 kJ/mol,故答案为:C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ/mol。

 阅读快车系列答案
阅读快车系列答案