题目内容
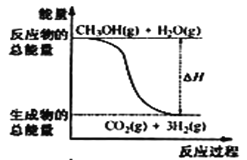
【题目】已知:2H2(g)+O2(g)═2H2O(l) △H= -571.6kJmol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) △H= -1452kJmol-1
H+(aq)+OH-(aq)═H2O(l) △H= -57.3kJmol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6kJmol-1
B.![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H=-57.3kJmol-1
BaSO4(s)+H2O(l) △H=-57.3kJmol-1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)═CH3OH(l)+H2O(l) △H=+131.4kJmol-1
【答案】C
【解析】
A.燃烧热为1mol可燃物燃烧放热,H2(g)的燃烧热为285.8kJmol-1,故A错误;
B.SO42-(aq)+Ba2+(aq)═BaSO4(s)△H<0,![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H<-57.3kJmol-1,故B错误;
BaSO4(s)+H2O(l) △H<-57.3kJmol-1,故B错误;
C.1g氢气放热![]() ,1g甲醇放热
,1g甲醇放热![]() ,所以同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多,故C正确;
,所以同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多,故C正确;
D.2H2(g)+O2(g)═2H2O(l) △H= -571.6kJmol-1①;2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) △H= -1452kJmol-1②;根据盖斯定律①![]() -②
-②![]() ,3H2(g)+CO2(g)═CH3OH(l)+H2O(l) △H=-131.4kJmol-1,故D错误。
,3H2(g)+CO2(g)═CH3OH(l)+H2O(l) △H=-131.4kJmol-1,故D错误。
答案选C。

【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用双氧水滴定KI-淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
B | 向食用加碘盐中加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐中含有KIO3 |
C | 用湿润的淀粉碘化钾试纸鉴别NO2、溴蒸气 | 试纸变蓝 | 该气体为溴蒸气 |
D |
| 最后试管有浅黄色沉淀 | 有机物中含有溴原子 |
A. AB. BC. CD. D
【题目】CO2是廉价的碳资源,其综合利用具有重要意义。
(1)CO2与CH4经催化重整反应CH4(g)+CO2(g)2CO(g)+2H2(g)△H=+120kJ·mol-1可以制得合成气。
已知上述反应中相关物质所含化学键键能数据如下:
化学键 | C-H | C=O | H-H | C≡O(CO) |
键能/kJ·mol-1 | a | b | c | x |
①x=___。
②分别在恒温密闭容器A(恒容)、B(恒压,体积可变)中,加入CH4和CO2各1mol的混合气体,起始体积均为VL。相同温度下两容器中反应达平衡后吸收热量较多的是___ (填“A”或“B”)。保持A容器的体积和B容器压强不变,写出一种能使A、B两容器中各物质的体积分数相同的方法:___。
③某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行反应,达到平衡时CO2的体积分数为![]() ,该温度下反应的平衡常数为___。
,该温度下反应的平衡常数为___。
(2)CO2可以被NaOH捕获。所得溶液中含碳微粒的分布百分数随pH的变化如图所示。H2CO3的二级电离平衡常数Ka2=___。pH=5.4时,φ(A):φ(B)=___。