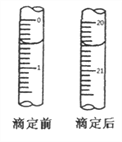
题目内容
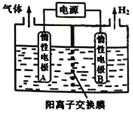
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电后,发现左侧溶液变蓝色,一段时间后,蓝色又逐渐变浅。(已知:3I2+ 6OH—= IO3—+5I—+3H2O , IO3—离子无色);下列说法不正确的是

A.右侧发生的电极反应式:2H2O+2e—= H2↑+2OH-
B.a为电源正极
C.电解结束时,右侧溶液中没有IO3—
D.用阴离子交换膜,电解槽内发生的总化学方程式为:KI + 3H2O ![]() KIO3+3H2↑
KIO3+3H2↑
【答案】C
【解析】A、左侧溶液变蓝色,生成I2,左侧电极为阳极,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,故A正确;B、左侧溶液变蓝色,生成I2,左侧电极为阳极,右侧电极为阴极,所以a为电源正极,故B正确;C、一段时间后,蓝色变浅,发生反应3I2+6OH-=IO3-+5I-+3H2O,中间为阴离子交换膜,右侧I-、OH-通过阴离子交换膜向左侧移动,保证两边溶液呈电中性,左侧的IO3-通过阴离子交换膜向右侧移动,故右侧溶液中含有IO3-,故C错误;D、左侧电极为阳极,电极反应为:2I--2e-=I2,同时发生反应3I2+6OH-=IO3-+5I-+3H2O,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,故总的电极反应式为:KI+3H2O![]() KIO3+3H2↑,故D正确;故选C。
KIO3+3H2↑,故D正确;故选C。

 53随堂测系列答案
53随堂测系列答案【题目】一种高分子化合物(VI)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):
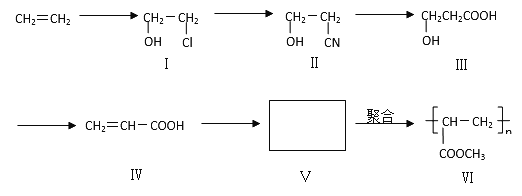
回答下列问题:
(1)目前工业上生产乙烯主要是以 为原料通过 反应来实现。
(2)化合物III生成化合物IV的另外一种产物是 。(提示:该反应的逆反应原子利用率为100%)
(3)写出合成路线中从化合物IV到化合物VI的两步反应的化学方程式: 、 。
(4)下列关于化合物III、IV和V的说法中,正确的是 (填字母)
A.化合物III可以发生氧化反应 |
B.化合物III不可以与NaOH 溶液反应 |
C.化合物IV能与氢气发生加成反应 |
D.化合物III、IV和V均可与金属钠反应生成氢气 |
E.化合物IV和V均可以使溴的四氯化碳溶液褪色