题目内容
2. 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产生氢气速率与反应时间的关系图.(1)下列关于图象的说法不正确的是③(填序号,下同);
①a→b段产生H2加快可能是表面的氧化膜逐渐溶解,加快了反应速率
②b→c段产生H2较快可能是该反应放热,导致温度升高,加快了反应
③c以后,产生H2速率逐渐下降可能是铝片趋于消耗完全
(2)其他条件不变,现换用500mL 1mol•L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol•L-1硫酸的快,可能的原因是②④;
①盐酸中c(H+)的浓度更大 ②Cl-有催化作用 ③SO42-有催化作用 ④SO42-有阻化作用(使反应变慢) ⑤Al3+有催化作用
(3)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:
①加入某种催化剂; ②加入蒸馏水;③将铝片换成铝粉;④增加硫酸的浓度至18mol/L; ⑤升高温度; ⑥加入少量CuSO4溶液.以上方案不合理的有②④;请你再补充两种合理方案,填入空白⑤⑥处.
分析 5.4gAl为0.2mol,500mL 0.5mol•L-1的硫酸溶液中含硫酸0.25mol,Al过量,能够将硫酸反应完全,由图可知,开始不生成氢气,为氧化铝与硫酸的反应,然后Al与硫酸反应生成氢气,开始温度较低,由于反应放热,则温度升高反应速率加快,后来,氢离子浓度减小,则反应速率减小;其他条件不变,现换用500mL 1mol•L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol•L-1硫酸的快,只能是氯离子起了催化作用.
解答 解:(1)5.4gAl为0.2mol,500mL 0.5mol•L-1的硫酸溶液中含硫酸0.25mol,Al过量,能够将硫酸反应完全,
①曲线a→b段产生H2加快可能是表面的氧化膜逐渐溶解,加快了反应速率,故①正确;
②曲线由b→c段,产生氢气的速率增加较快的主要原因为该反应为放热反应,温度升高,反应速率加快,故②正确;
③曲线由c以后,产生氢气的速率逐渐下降的主要原因为氢离子浓度减小,反应速率减小,故③错误;
故答案为:③;
(2)其他条件不变,现换用500mL 1mol•L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol•L-1硫酸的快,只能是氯离子起了催化作用,SO42-有阻化作用,其它因素相同,
故答案为:②④;
(3)①加入某种催化剂,加快反应速率; ②加入蒸馏水,稀释溶液,反应速率减慢;③将铝片换成铝粉,增大反应物的接触面积,反应速率增大;④增加硫酸的浓度至18mol/L,发生钝化;其他加快铝与硫酸溶液制H2的反应速率有升高温度;加入少量CuSO4溶液,形成原电池等;
故答案为:升高温度,加入少量CuSO4溶液;②④.
点评 本题考查了化学反应速率的影响因素,为高频考点,侧重于学生的分析能力的考查,难度不大,注意根据图象分析理解随反应进行影响反应速率的主要因素.

 教学练新同步练习系列答案
教学练新同步练习系列答案| A. | CuSO4•5H2O | B. | 无水硫酸铜 | C. | 浓硫酸 | D. | 氢氧化钠 |
| A. | 取a克混合物与足量浓盐酸充分反应,通过排饱和NaHCO3溶液测得生成气体b升(标准状况) | |
| B. | 取a克混合物与足量硝酸银溶液充分反应,过滤、洗涤、烘干,得b克固体 | |
| C. | 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 | |
| D. | 取a克混合物与足量Ba(OH)2溶液充分反应,过滤,称量得b克固体 |

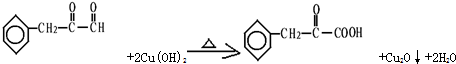
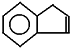 ,茚有一种同分异构体A,A分子中含有一个苯环且只有一个侧链,A有如下转化关系:
,茚有一种同分异构体A,A分子中含有一个苯环且只有一个侧链,A有如下转化关系: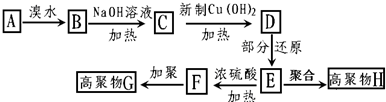
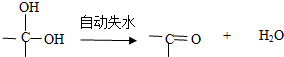
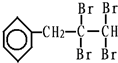 、C的结构简式:
、C的结构简式: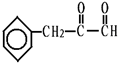

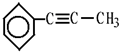
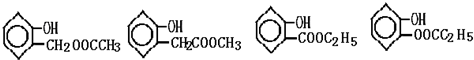 (任写一个)
(任写一个)