题目内容
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。请回答下列问题:
(1)基态Fe原子的价电子轨道表示式(电子排布图)为____,O2-核外电子有___种运动状态。
(2)锂的紫红色焰色是一种_______光谱,LiFePO4中阴离子VSEPR模型名称为______,中心原子的杂化轨道类型为____。
(3)一般情况下,同种物质固态时密度比液态大,但普通冰的密度比水小,原因是____________;H2O2难溶于CS2,简要说明理由:____________________。
(4)Li2O是离子晶体,其晶体能可通过如图甲的Born - Haber循环计算得到。可知,Li2O晶格能为____kJ/mol。

(5)磷化钛熔点高、硬度大,其晶胞如图乙所示。
①磷化钛晶体中Ti原子周围最邻近的Ti数目为____;设晶体中Ti原子与最邻近的P原子之间的距离为r,则Ti原子与跟它次邻近的P原子之间的距离为_______。
②设磷化钛晶体中Ti、P原子半径分别为a pm、b pm,它们在晶体中紧密接触,则该晶胞中原子的空间利用率为_____ (用a、b表示)。
【答案】![]() 10 发射 正四面体 sp3 液态水中分子间相对自由,冰中每个水分子中的氢原子和氧原子共参与形成4个氢键,水分子形成正四面体,分子间距离增大,密度减小 H2O2为极性分子,CS2为非极性分子,根据相似相溶原理,H2O2难溶于CS2 2908 12
10 发射 正四面体 sp3 液态水中分子间相对自由,冰中每个水分子中的氢原子和氧原子共参与形成4个氢键,水分子形成正四面体,分子间距离增大,密度减小 H2O2为极性分子,CS2为非极性分子,根据相似相溶原理,H2O2难溶于CS2 2908 12 ![]() r
r 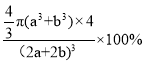
【解析】
(1) Fe的电子排布式是[Ar]3d64s2, O2-核外电子总数为10,其原子核外有10种运动状态不同的电子;
(2)PO43-中P原子价层电子对个数=![]() ,且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型及P原子的杂化形式;
,且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型及P原子的杂化形式;
(3) 液态水中分子间相对自由,冰中每个水分子中的氢原子和氧原子共参与形成4个氢键,水分子形成正四面体,使水分子之间间隙增大,密度变小,导致固态H2O的密度比其液态时小, H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”规律可知;
(4) 晶格能是气态离子形成1mol离子晶体释放的能量
(5) ①有一个Ti原子位于体心,在三维坐标中,体心Ti原子可以形成3个面,每一个形成的面上有4个Ti原子;由晶胞的截图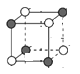 可知,顶点Ti原子与小立方体顶点P原子最邻近,与体对角线的P原子次近邻;
可知,顶点Ti原子与小立方体顶点P原子最邻近,与体对角线的P原子次近邻;
②磷化钛晶胞为面心立方密堆积,晶胞中P原子位于顶点和面心上,Ti位于棱边上和体内,利用均摊法计算。
(1) Fe的电子排布式是[Ar]3d64s2,价电子轨道表示式(电子排布图)为![]() ,故答案为:
,故答案为:![]() ; O2-核外电子总数为10,其原子核外有10种运动状态不同的电子,故答案为10;
; O2-核外电子总数为10,其原子核外有10种运动状态不同的电子,故答案为10;
(2)紫红色波长介于380-435nm之间,是一种发射光谱,故答案为:发射;PO43-中P原子价层电子对个数=![]() ,且不含孤电子对,据价层电子对互斥理论判断该微粒VSEPR模型为正四面体形、P原子的杂化形式为sp3;故答案为正四面体、sp3;
,且不含孤电子对,据价层电子对互斥理论判断该微粒VSEPR模型为正四面体形、P原子的杂化形式为sp3;故答案为正四面体、sp3;
(3) 液态水中分子间相对自由,冰中每个水分子中的氢原子和氧原子共参与形成4个氢键,水分子形成正四面体,使水分子之间间隙增大,密度变小,导致固态H2O的密度比其液态时小,故答案为:液态水中分子间相对自由,冰中每个水分子中的氢原子和氧原子共参与形成4个氢键,水分子形成正四面体,分子间距离增大,密度减小; H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”规律可知,H2O2难溶于CS2,
故答案为:H2O2为极性分子,CS2为非极性分子,根据相似相溶原理,H2O2难溶于CS2;
(4) 图中: 2Li(晶体)+1/2O2(g)=Li2O(晶体)的△H=-598KJ·mol1 ,Li原子的第一电离能为Li原子失去1个电子所需要的能量,所以其第一电离能为1040/2kJ·mol-1=520kJ·mol-1;O=O键键能为氧气分子变为氧原子所需能量,其键能=2×249kJ·mol-1=498kJ·mol-1;晶格能是气态离子形成1mol离子晶体释放的能量,所以其晶格能为2908kJ·mol-1,故答案为:2908;
(5) ①根据磷化钛晶体可知,有一个Ti原子位于体心,在三维坐标中,体心Ti原子可以形成3个面,每一个形成的面上有4个Ti原子,则该Ti原子最邻近的Ti的数目为3×4=12个;由晶胞的截图 可知,顶点Ti原子与小立方体顶点P原子最邻近,与体对角线的P原子次近邻,Ti原子与跟它最邻近的P原子之间的距离为r,则跟它次邻近的P原子之间的距离为
可知,顶点Ti原子与小立方体顶点P原子最邻近,与体对角线的P原子次近邻,Ti原子与跟它最邻近的P原子之间的距离为r,则跟它次邻近的P原子之间的距离为![]() =
=r,故答案为:12;
![]() r;
r;
②磷化钛晶胞为面心立方密堆积,晶胞中P原子位于顶点和面心上,Ti位于棱边上和体内,每个晶胞中含有的P原子个数为8×![]() +6×
+6×![]() =4,含有的Ti原子个数为 12×
=4,含有的Ti原子个数为 12×![]() +1=4,P原子和Ti原子的体积之和为
+1=4,P原子和Ti原子的体积之和为![]() π(a+b)3×4 pm3,晶胞的边长(2a+2b)pm,体积为(2a+2b)3pm3,则在磷化钛晶体中原子的空间利用率为
π(a+b)3×4 pm3,晶胞的边长(2a+2b)pm,体积为(2a+2b)3pm3,则在磷化钛晶体中原子的空间利用率为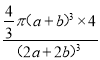 ×100%,故答案为:
×100%,故答案为: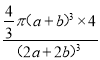 ×100%;
×100%;

【题目】某同学在用稀硫酸与过量的锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是___________________;并用简单的装置图来表明你所阐述的理由______________________________;
(2)要加快上述实验中气体产生的速率,还可采取的措施有_______________;
(3)下列物质的加入能减慢氢气生成速率但不影响生成氢气的体积的是_____
A.加入碳酸钠溶液 B.加入硫酸钠溶液
C.加入硝酸钠溶液 D.加入醋酸钠溶液
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到 6 个盛有过量 Zn 粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
混合溶液实验 | 1 | 2 | 3 | 4 | 5 | 6 |
4mol·mol-1H2SO4/mL | 40 | V1 | V2 | V3 | V4 | V5 |
饱和 CuSO4 溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V6、V8 分别是_____________;
②该同学最后得出的结论为:当加入少量 CuSO4 溶液时,生成氢气的速率会大大提高,随着加入的 CuSO4 溶液增多时,生成氢气的速率会______(填加快、减慢或不变)。理由___________________。