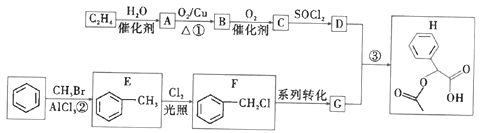
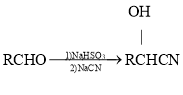
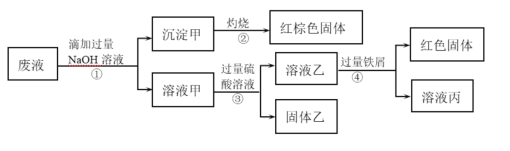
题目内容
【题目】碳酸氢钠是重要的化工产品。用标准盐酸溶液滴定可测定碳酸氢钠样品中碳酸氢钠含量。已知碳酸氢钠受热易分解,且在250℃~270℃分解完全。
完成下列填空:
(1)测定碳酸氢钠含量的实验步骤:用电子天平称取碳酸氢钠样品(准确到_____g),加入锥形瓶中,加入使之完全溶解;加入甲基橙指示剂,用标准盐酸溶液滴定。当滴定至溶液由_____色变为_____色,半分钟不变色为滴定终点,记录读数。该实验不能用酚酞作指示剂的原因是_____。
(2)若碳酸氢钠样品质量为0.840g,用0.5000mol/L的标准盐酸溶液滴定至终点,消耗标准盐酸溶液19.50mL。样品中NaHCO3的质量分数为_____(保留3位小数)。
(3)如果滴定尖嘴部分在滴定过程中出现气泡,且滴定终点读数时气泡未消失,会导致测定结果____(选填“偏高”、“偏低”或“不受影响”)。
(4)碳酸氢钠样品含有少量水分(<0.5%)和氯化钠。以下是测定碳酸氢钠样品中水分的实验方案(样品中NaHCO3含量已知)。
①在恒重的坩埚中称取碳酸氢钠样品,样品和坩埚的质量为m1g。
②将样品和坩埚置于电热炉内,在250℃~270℃加热分解至完全,经恒重,样品和坩埚的质量为m2g。
③……。
该实验方案中,质量差(m1-m2)是_____的质量。若所称取样品中NaHCO3的质量为m3g,则样品中水分的质量m=_____(用含m、m1、m2的代数式表示)。
【答案】0.001 黄 橙 滴定终点溶液呈弱酸性,酚酞的变色范围为8-10,无法准确判断滴定终点 0.975 偏低 碳酸氢钠分解生成的CO2、H2O和样品中的含有的水分 m1-m2-![]()
【解析】
(1)电子天平能准确到小数点后三位;碳酸氢钠的溶液中滴加甲基橙指示剂,溶液呈黄色;而弱酸性的溶液中滴加甲基橙指示剂,溶液呈橙色;酚酞试液在pH≥8的溶液中才呈红色;
(2)根据NaHCO3~HCl,则n(NaHCO3)=n(HCl)计算;
(3)根据c(待测)= 分析不当操作对V(标准)的影响,以此判断浓度的误差;
分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)由2NaHCO3![]() Na2CO3+H2O+CO2↑可知加热前后固体质量减轻,主要是生成CO2气体和水蒸气;先计算出m3gNaHCO3分解生成的水和CO2的质量,再计算样品中含有的水分质量。
Na2CO3+H2O+CO2↑可知加热前后固体质量减轻,主要是生成CO2气体和水蒸气;先计算出m3gNaHCO3分解生成的水和CO2的质量,再计算样品中含有的水分质量。
(1)用电子天平称取碳酸氢钠样品能准确到0.001g;碳酸氢钠溶液中加入甲基橙指示剂,溶液呈黄色,用标准盐酸溶液滴定,当滴定至溶液由黄色变为橙色,半分钟不变色为滴定终点;因滴定终点溶液呈弱酸性,而酚酞试液的变色范围为8-10,用酚酞作指示剂将无法准确判断滴定终点;
(2)滴定至终点消耗0.5000mol/L的标准盐酸溶液19.50mL,则参加反应的HCl为0.5000mol/L×0.01950L=0.00975mol,根据NaHCO3~HCl,则n(NaHCO3)=n(HCl),0.840g样品中m(NaHCO3)=0.00975mol×84g/mol=0.819g,故样品中NaHCO3的质量分数为![]() =0.975;
=0.975;
(3)滴定管尖嘴部分在滴定前没有气泡,滴定过程中出现气泡,且滴定终点读数时气泡未消失,导致消耗标准液偏小,则测定结果偏低;
(4)已知2NaHCO3![]() Na2CO3+H2O+CO2↑,则该实验方案中,质量差(m1-m2)是碳酸氢钠分解生成的CO2、H2O和样品中的含有的水分;称取样品中NaHCO3的质量为m3g,则完全反应生成的碳酸钠质量为m4g,
Na2CO3+H2O+CO2↑,则该实验方案中,质量差(m1-m2)是碳酸氢钠分解生成的CO2、H2O和样品中的含有的水分;称取样品中NaHCO3的质量为m3g,则完全反应生成的碳酸钠质量为m4g,

m4=![]() g,生成的水和CO2的质量为m3g -
g,生成的水和CO2的质量为m3g - ![]() g=
g=![]() m3g,故所则样品中水分的质量m= m1-m2-
m3g,故所则样品中水分的质量m= m1-m2-![]() m3g。
m3g。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案