题目内容
4.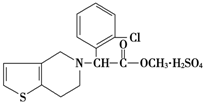 波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来希望.波立维属于硫酸氢盐,它的结构如图所示.下列关于它的说法正确的是( )
波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来希望.波立维属于硫酸氢盐,它的结构如图所示.下列关于它的说法正确的是( )| A. | 该物质的化学式为C16H15ClNO2•H2SO4 | |
| B. | 该物质不溶于水 | |
| C. | 波立维属于硫酸氢盐,它的形成与其结构中的氮原子有关 | |
| D. | 它可以与NaOH溶液反应,1 mol该物质最多可消耗2 mol NaOH |
分析 由结构简式确定有机物含有的元素种类和原子格式,可确定有机物分子式,因属于硫酸氢盐,可溶于水,能与氢氧化钠反应的C|、酯基以及硫酸,以此解答.
解答 解:A.该物质的化学式为C16H16ClNO2•H2SO4,故A错误;
B.该物质属于盐类,含有亲水的磺酸基,应该易溶于水,故B错误;
C.结构中只有氮原子为碱性基团,可与硫酸形成硫酸氢盐,故C正确;
D.该物质与NaOH反应,苯环上Cl原子消耗2mol(1mol水解,1mol中和)酯基消耗1mol,“H2SO4”消耗2molNaOH,总共5mol,故D错误.
故选C.
点评 本题考查有机物的结构和性质,为高考常见题型和高频考查,侧重于学生的分析能力的考查,注意把握有机物的结合特点和官能团的性质,为解答该题的关键,难度不大.

练习册系列答案
 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
14.(1)已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
①反应速率最大的(即0min~1min、1min~2min、2min~3min、3min~4min、4min~5min)时间段为2 min~3 min,原因是因该反应是放热反应,此时温度高.
②反应速率最小的时间段为4 min~5 min,原因是此时H+浓度小.
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入以下物质以减缓反应速率
A.蒸馏水 B.更加细小的锌粒 C.NaCl溶液
你认为他的做法可行的是AC(填相应字母)
| 时间 (min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
②反应速率最小的时间段为4 min~5 min,原因是此时H+浓度小.
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入以下物质以减缓反应速率
A.蒸馏水 B.更加细小的锌粒 C.NaCl溶液
你认为他的做法可行的是AC(填相应字母)
15.下列各组中两个化学反应,属于同一反应类型的一组是( )
| A. | 由苯制硝基苯;由苯制环己烷 | |
| B. | 由乙烯制1,2-二溴乙烷;由乙烷制一氯乙烷 | |
| C. | 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 由苯制溴苯;由乙烷与氯气在光照下的反应 |
12.以下叙述中,错误的是( )
| A. | 非金属元素只能形成共价化合物 | |
| B. | 在NaCl中,除Na+和Cl-的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 | |
| C. | 任何离子键在形成过程中必定有电子的得与失 | |
| D. | 离子化合物可能含有共价键原子核之间的排斥作用 |
19.下列各组混合物能用分液漏斗直接分离的是( )
| A. | 煤油和汽油 | B. | 乙酸乙酯和水 | C. | 溴和苯 | D. | 乙醇和水 |
9.下列关于卤素的叙述,正确的是( )
| A. | 单质的颜色随核电荷数的增加逐渐加深 | |
| B. | 卤化银的溶解度随核电荷数的增加逐渐增大 | |
| C. | 单质与水反应均可表示为X2+H2O═HX+HXO | |
| D. | 随核电荷数的增加,X-的半径递增,还原性递减 |
16.下列混合气体比乙烯含碳质量分数高的是( )
| A. | 甲烷+乙烯 | B. | 乙烷+丁烯 | C. | 乙炔+丙烯 | D. | 乙烷+丙烯 |
13.下列说法不正确的是( )
| A. | 使用可再生能源,用超临界二氧化碳替代有机溶剂,注重原子经济性,采用低能耗生产工艺等都是绿色化学的内容 | |
| B. | 13C与14C属于同一种元素,它们互为同位素 | |
| C. | 通过化学变化可以实现235U与238U的相互转化 | |
| D. | 同位素示踪法是研究化学反应历程的手段之一 |