题目内容
【题目】工业上烟气脱氮的原理 NO(g) + NO2(g) + 2NH3(g)2N2(g) + 3H2O(g)+Q(Q>0)
(1)该反应化学平衡常数 K 的表达式为_____________________。如果平衡常数 K 值增大,对_______(填“正反应”或“逆反应”)的速率影响更大。
(2)若反应在恒容条件下进行,能说明反应已经达到平衡状态的是______(填序号)
a.容器内混合物的质量不变
b.容器内气体的压强不变
c.反应消耗 0.5mol NO 的同时生成 1mol N2 d.NO2 的浓度不变
(3)向 2 L 密闭容器中加入反应物,10 min 后达到平衡,测得平衡时气体的物质的量增加了 0.2mol,则用H2O(g)表示的平均反应速率为__________________。
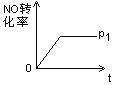
(4)如图是 P1 压强下 NO 的转化率随反应时间(t)的变化图,请在图中画出其他条件不变情况下,压强为P2(P2> P1)下 NO 的转化率随反应时间变化的示意图________________。
(5)写出反应物中的氨气的电子式______;其空间构型为______;它常用来生产化肥 NH4Cl。NH4Cl 溶液显_____________性;常温下将等体积等浓度的氨水和NH4Cl溶液混合,pH>7,溶液中 NH3·H2O、H+、OH-、NH4+、Cl 一浓度由大到小的关系是____________________。
【答案】 K=[N2]2 [H2O]3/([NO][NO2] [NH3]2) 逆反应 bd 0.03mol/(L·min) 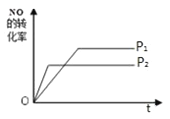
![]() 三角锥形 酸性 c(NH4+)> c(Cl-)> c(NH3·H2O)> c(OH-)>c(H+)
三角锥形 酸性 c(NH4+)> c(Cl-)> c(NH3·H2O)> c(OH-)>c(H+)
【解析】(1)根据方程式可知该反应化学平衡常数K的表达式为K=[N2]2 [H2O]3/([NO][NO2][NH3]2)。如果平衡常数K值增大,说明平衡向正反应方向进行,因此对逆反应的速率影响更大。(2)a.根据质量守恒定律可知容器内混合物的质量始终不变,a错误;b.正方应体积减小,则容器内气体的压强不变说明达到平衡状态,b正确;c.根据方程式可知反应消耗0.5molNO的同时一定生成1molN2,不能说明反应达到平衡状态,c错误;d.NO2 的浓度不变说明达到平衡状态,d正确,答案选bd;(3)根据方程式可知每生成3mol水蒸气,混合气体的物质的量就增加1mol,因此平衡时气体的物质的量增加了0.2mol,说明生成0.6mol水蒸气,则用H2O(g)表示的平均反应速率为![]() =0.03mol/(L·min)。(4)正方应体积减小,增大压强平衡向逆反应方向进行,NO转化率降低,所以NO的转化率随反应时间变化的示意图为
=0.03mol/(L·min)。(4)正方应体积减小,增大压强平衡向逆反应方向进行,NO转化率降低,所以NO的转化率随反应时间变化的示意图为 。(5)氨气是含有极性键的共价化合物,电子式是
。(5)氨气是含有极性键的共价化合物,电子式是![]() ,其空间构型为三角锥形;NH4Cl是强酸弱碱盐,铵根水解溶液显酸性;常温下将等体积等浓度的氨水和NH4Cl溶液混合,pH>7,说明一水合氨的电离程度大于铵根的水解程度,则溶液中 NH3·H2O、H+、OH-、NH4+、Cl 一浓度由大到小的关系是c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-) >c(H+)。
,其空间构型为三角锥形;NH4Cl是强酸弱碱盐,铵根水解溶液显酸性;常温下将等体积等浓度的氨水和NH4Cl溶液混合,pH>7,说明一水合氨的电离程度大于铵根的水解程度,则溶液中 NH3·H2O、H+、OH-、NH4+、Cl 一浓度由大到小的关系是c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-) >c(H+)。