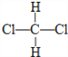
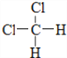
题目内容
【题目】随原子序数递增,八种短周期元素(用字母等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是___________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):______>_____;比较g、h的最高价氧化物对应水化物的酸性强弱:______>______。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:________。
【答案】 第三周期ⅢA族 r(O2-) r(Na+) HClO4 H2SO4 ![]() (或
(或![]()
![]() 等其他合理答案均可)
等其他合理答案均可)
【解析】从图中的化合价和原子半径的大小,可以推出x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素。则
(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族。(2)电子层结构相同的离子,核电荷数越大离子半径越小,故r(O2-)>r(Na+);非金属性越强最高价氧化物水化物的酸性越强,故HClO4>H2SO4;(3)四原子共价化合物,可以是NH3、H2O2、C2H2等,其电子式为:![]() (或
(或![]()
![]() )。
)。

 名校课堂系列答案
名校课堂系列答案【题目】已知碳碳单键可以旋转,结构简式为 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A. 该烃属于苯的同系物
B. 分子中最多有6个碳原子处于同一直线上
C. 该烃的一氯代物有4种
D. 分子中最多有10个碳原子处于同一平面上
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙醇、无水醋酸钠、碎瓷片,D中盛有饱和碳酸钠溶液。

已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是_______________________________________________;
(2)球形干燥管C的作用是_______________________。反应结束后D中的现象是________________________________________________________________________________;
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,除去_________;
再加入_______除水(填写选项字母),然后进行___________(填写操作名称),得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰