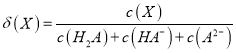题目内容
【题目】(6分)将4molSO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2(g)+O2(g)![]() 2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时SO3的浓度;
(2)该温度下的平衡常数;
(3)平衡时SO2的转化率。
【答案】(共6分)(1) c(SO3)=0.5mol/L (2)K=4 (3)50% (各2分)
【解析】试题分析:(1)假设反应消耗的氧气的物质的量是x,则根据反应方程式2SO2(g)+O2(g)![]() 2SO3(g)可知,每有1mol氧气反应,反应后气体减小的物质的量是1mol。由于反应前气体的物质的量是6mol,反应后测得平衡时混合物总的物质的量为5mol,则减少1mol,所以反应消耗氧气1mol,消耗SO22mol,产生SO32mol,则平衡时SO3的浓度是c(SO3)= 2mol÷4L=0.5mol/L。(2)平衡时各种物质的浓度分别是c(SO2)= 4mol÷4L-0.5mol/L=0.5mol/L;c(O2)=" (2mol-1mol)" ÷4L=0.25mol/L;c(SO3)= 2mol÷4L=0.5mol/L。则该反应的化学平衡常数是
2SO3(g)可知,每有1mol氧气反应,反应后气体减小的物质的量是1mol。由于反应前气体的物质的量是6mol,反应后测得平衡时混合物总的物质的量为5mol,则减少1mol,所以反应消耗氧气1mol,消耗SO22mol,产生SO32mol,则平衡时SO3的浓度是c(SO3)= 2mol÷4L=0.5mol/L。(2)平衡时各种物质的浓度分别是c(SO2)= 4mol÷4L-0.5mol/L=0.5mol/L;c(O2)=" (2mol-1mol)" ÷4L=0.25mol/L;c(SO3)= 2mol÷4L=0.5mol/L。则该反应的化学平衡常数是![]() 。(3)平衡时SO2的转化率φ=(2mol÷4mol)×100%=50%。
。(3)平衡时SO2的转化率φ=(2mol÷4mol)×100%=50%。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目