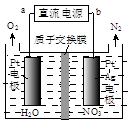题目内容
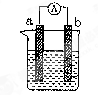
如图所示的原电池装置中,锌为 极,电极发生的是 反应(填氧化或还原),电极反应式为 ;铜电极反应式为 ,铜片上观察到的现象为 。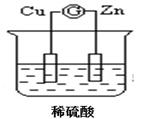
(5分) 负 氧化 Zn-2e-=Zn2+ 2H++2e-=H2↑ 铜片表面有气泡出现
解析试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据装置图可知,锌的金属性强于铜,所以锌是负极,失去电子,发生氧化反应,电极反应式是Zn-2e-=Zn2+;铜是正极,溶液中的氢离子在正极得到电子,发生还原反应,电极反应式是2H++2e-=H2↑,所以铜片上观察到的现象为铜片表面有气泡出现。
考点:考查原电池原理的应用和有关判断
点评:该题是基础性试题的考查,难度不大。明确原电池的工作原理,是答题的关键,有利于调动学生的学习兴趣,激发学生的学习积极性。

练习册系列答案
相关题目
由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用下图电解实验可以制得白色的纯净的Fe (OH)2沉淀。两电极材料分别为石墨和铁。
(1)b电极材料应为____,电极反应式为________________。
(2)电解液C可以是__________。
| A.纯净水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
化学在人类生活中扮演着重要角色,以下应用不正确的是( )
| A.用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 |
| B.福尔马林是一种良好的杀菌剂,能用来消毒饮用水 |
| C.医疗上常用体积分数为70%~75%的酒精作消毒剂 |
| D.为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒 |






 CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。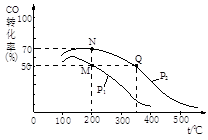
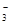 还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为 。
还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为 。