��Ŀ����
ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̡�
��1����ˮ����ͨ�����ȵ�̿���ɲ���ˮú������ӦΪ��C(s)��H2O(g)  CO(g)��H2(g) ��H����131.3 kJ��mol��1һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���� (����ĸ����ͬ)
CO(g)��H2(g) ��H����131.3 kJ��mol��1һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���� (����ĸ����ͬ)
A�������е�ѹǿ����
B��1 mol H��H�����ѵ�ͬʱ����2 mol H��O��
C��v��(CO)��v��(H2O)
D��c(CO)��c(H2)
��2������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2 L�ĺ����ܱ������У����з�ӦCO(g)��H2O(g)  CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
| ʵ �� �� | �� �� /�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
�ٸ÷�Ӧ���淴ӦΪ (������š�)�ȷ�Ӧ��
����ʵ��3Ҫ�ﵽ��ʵ��2��ͬ��ƽ��״̬(�������ʵ����������ֱ����)����t<3 min����a��bӦ����Ĺ�ϵ�� (�ú�a��b����ѧʽ��ʾ)��
(3)Ŀǰ��ҵ����һ�ַ�������CO2�������״���һ�������·�����Ӧ��CO2(g)+3H2(g)
 CH3OH(g) +H2O(g)����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ��mol��1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2�� ���д�ʩ����ʹ c(CH3OH)�������
CH3OH(g) +H2O(g)����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ��mol��1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2�� ���д�ʩ����ʹ c(CH3OH)������� 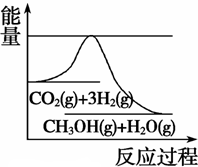
A�������¶�
B������N2(g)��ʹ��ϵѹǿ����
C����H2O(g)����ϵ�з������
D���ٳ���0.5 mol CO2��1.5 mol H2
(1)B��C (2) �� ���ȣ� ��b=2a����a>1 (3)C��D
�������������(1)���ڷ�ӦC(s)��H2O(g)  CO(g)��H2(g)������Ӧ�Ǹ������������ķ�Ӧ��A������Ӧδ�ﵽƽ�⣬�������е�ѹǿ�ᷢ���ı䣬����Ӧ�ﵽ��ƽ�⣬�������������ѹǿ���䡣��ȷ��B��1 mol H��H�����Ѿͻ����1mol��ˮ�����γ���2mol��H��O������ͬʱ����2 mol H��O����˵������ͬ��������˵����λʱ�������������������ȡ���Ӧ�ﵽƽ�⡣��ȷ��D��CO��H2����������ڷ���ʽ�ж��ߵ�ϵ����ͬ���������κ�ʱ����c(CO)��c(H2)���ʲ���ȷ����Ӧ�ﵽƽ�⡣��������ѡ��ΪB C����2���� ��ӦCO(g)��H2O(g)
CO(g)��H2(g)������Ӧ�Ǹ������������ķ�Ӧ��A������Ӧδ�ﵽƽ�⣬�������е�ѹǿ�ᷢ���ı䣬����Ӧ�ﵽ��ƽ�⣬�������������ѹǿ���䡣��ȷ��B��1 mol H��H�����Ѿͻ����1mol��ˮ�����γ���2mol��H��O������ͬʱ����2 mol H��O����˵������ͬ��������˵����λʱ�������������������ȡ���Ӧ�ﵽƽ�⡣��ȷ��D��CO��H2����������ڷ���ʽ�ж��ߵ�ϵ����ͬ���������κ�ʱ����c(CO)��c(H2)���ʲ���ȷ����Ӧ�ﵽƽ�⡣��������ѡ��ΪB C����2���� ��ӦCO(g)��H2O(g)  CO2(g)��H2(g)��650��ʱ����ʼʱn(CO)=4mol��n(H2O)=2mol��n(CO2)=0��n(H2)=0.����Ӧ�ﵽƽ��ʱ�������ʵ����ʵ���Ϊn(CO)=4mol��1.6mol=2.4mol��n(H2O)=2mol��1.6mol=0.4mol,n(CO2)=1.6mol��n(H2)=1.6mol�����ڸ÷�Ӧ��˵������ϵ������1�����Դﵽƽ��״̬ʱ��ƽ�ⳣ��Ϊ
CO2(g)��H2(g)��650��ʱ����ʼʱn(CO)=4mol��n(H2O)=2mol��n(CO2)=0��n(H2)=0.����Ӧ�ﵽƽ��ʱ�������ʵ����ʵ���Ϊn(CO)=4mol��1.6mol=2.4mol��n(H2O)=2mol��1.6mol=0.4mol,n(CO2)=1.6mol��n(H2)=1.6mol�����ڸ÷�Ӧ��˵������ϵ������1�����Դﵽƽ��״̬ʱ��ƽ�ⳣ��Ϊ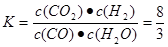 ����900��ʱ����ʼʱn(CO)=2mol��n(H2O)=1mol��n(CO2)=0��n(H2)=0.����Ӧ�ﵽƽ��ʱ�������ʵ����ʵ���Ϊn(CO)= 1.6mol��n(H2O)=1mol��0.4mol=0.6mol,n(CO2)=0.4mol��n(H2)=0.4mol�����ڸ÷�Ӧ��˵������ϵ������1�����Դﵽƽ��״̬ʱ��Ũ�ȱ�Ϊ���ʵ����ıȡ������ڸ��¶���ƽ�ⳣ��Ϊ
����900��ʱ����ʼʱn(CO)=2mol��n(H2O)=1mol��n(CO2)=0��n(H2)=0.����Ӧ�ﵽƽ��ʱ�������ʵ����ʵ���Ϊn(CO)= 1.6mol��n(H2O)=1mol��0.4mol=0.6mol,n(CO2)=0.4mol��n(H2)=0.4mol�����ڸ÷�Ӧ��˵������ϵ������1�����Դﵽƽ��״̬ʱ��Ũ�ȱ�Ϊ���ʵ����ıȡ������ڸ��¶���ƽ�ⳣ��Ϊ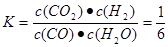 �������¶ȣ���ѧƽ�ⳣ����С��˵�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ������ʵ��3Ҫ�ﵽ��ʵ��2��ͬ��ƽ��״̬(�������ʵ����������ֱ����)����t<3 min����Ϊ��Ӧ��ƽ��״̬��ͬ��������ʽ��ϵ����ͬ������ֻҪ��Ӧ������ʵ����ı���ԭƽ�����ʼʱ�����ʵ����ı���ͬ�������ߵ����ʵ����ı�Ϊa:b=1:2��ƽ�ⲻ�����ƶ���������������ѹǿ����Ӧ������ʵ���Ũ������ѧ��Ӧ���ʼӿ죬�ﵽƽ������Ҫ��ˮ�����̡�(3)��ͼ����Կ����÷�ӦΪ���ȷ�Ӧ��A�������¶ȡ�����ƽ���ƶ�ԭ������ѧƽ�����淴Ӧ�����ƶ���c(CH3OH)��С������B������N2���Ƿ�Ӧ��ϵ�����壬����N2(g)��ʹ��ϵѹǿ�����Ƿ�Ӧ������и����ʵ�Ũ�Ȳ��䣬����ƽ�ⲻ�����ƶ���c(CH3OH)���䡣����C. ��H2O(g)����ϵ�з������,��С�������Ũ�ȣ�ƽ�������ƶ���c(CH3OH)������ȷ��D�����ٳ���0.5 mol CO2��1.5 mol H2������Ӧ���Ũ�ȣ���ѧƽ�������ƶ���c(CH3OH)������ȷ��
�������¶ȣ���ѧƽ�ⳣ����С��˵�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ������ʵ��3Ҫ�ﵽ��ʵ��2��ͬ��ƽ��״̬(�������ʵ����������ֱ����)����t<3 min����Ϊ��Ӧ��ƽ��״̬��ͬ��������ʽ��ϵ����ͬ������ֻҪ��Ӧ������ʵ����ı���ԭƽ�����ʼʱ�����ʵ����ı���ͬ�������ߵ����ʵ����ı�Ϊa:b=1:2��ƽ�ⲻ�����ƶ���������������ѹǿ����Ӧ������ʵ���Ũ������ѧ��Ӧ���ʼӿ죬�ﵽƽ������Ҫ��ˮ�����̡�(3)��ͼ����Կ����÷�ӦΪ���ȷ�Ӧ��A�������¶ȡ�����ƽ���ƶ�ԭ������ѧƽ�����淴Ӧ�����ƶ���c(CH3OH)��С������B������N2���Ƿ�Ӧ��ϵ�����壬����N2(g)��ʹ��ϵѹǿ�����Ƿ�Ӧ������и����ʵ�Ũ�Ȳ��䣬����ƽ�ⲻ�����ƶ���c(CH3OH)���䡣����C. ��H2O(g)����ϵ�з������,��С�������Ũ�ȣ�ƽ�������ƶ���c(CH3OH)������ȷ��D�����ٳ���0.5 mol CO2��1.5 mol H2������Ӧ���Ũ�ȣ���ѧƽ�������ƶ���c(CH3OH)������ȷ��
���㣺���黯ѧƽ��״̬���жϡ���Ӧ�ȵļ��㼰��������Ի�ѧƽ���ƶ���Ӱ���֪ʶ��

 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�(8��)ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯������100 mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼����(�ۼ�ֵ�����������Ϊ������)��
| ʱ��(min) | 1 | 2 | 3 | 4 | 5 |
| �������(mL) | 50 | 120 | 232 | 290 | 310 |
ԭ���� ��
(2)��2��3����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����(����Һ�������)
(3)�����Ӧ̫���ң�Ϊ�˼�����Ӧ���ʶ��ֲ����ٲ����������������������зֱ�������
����������Һ������Ϊ���е���__________��
A������ˮ B��NaCl��Һ C��NaNO3��Һ D��CuSO4��Һ E��Na2CO3��Һ
(9��)��֪A(g)+B(g)  C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
| |�¶�/ �� | 700 | 900 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)�÷�Ӧ��ƽ�ⳣ������ʽK= ����H 0���<���� >���� =��)��
(2)830��ʱ����һ��5 L���ܱ������г���0.20mol��A��0.80mol��B���練Ӧ��ʼ6s��A��ƽ����Ӧ����v(A)=0��003 mol��L-1��s-1����6sʱc(A)= mol��L-1�� C�����ʵ���Ϊ mol������Ӧ��һ��ʱ��ﵽƽ��ʱA��ת����Ϊ �������ʱ����ܱ��������ٳ���1 mol�����ƽ��ʱA��ת����Ϊ ��
(3)�жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ (����ȷѡ��ǰ����ĸ)��
a��ѹǿ����ʱ��ı� b��������ܶȲ���ʱ��ı�
c��c(A)����ʱ��ı� d����λʱ��������C��D�����ʵ������
(4)1200��ʱ��ӦC(g)+D(g)
 A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
A(g)+B(g)��ƽ�ⳣ����ֵΪ ��  CH3OCH3��g��+3H2O��g�� ��H=-122��4kJ��mol��1
CH3OCH3��g��+3H2O��g�� ��H=-122��4kJ��mol��1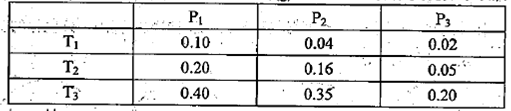
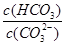 ����������䡱��С��������̼�����Һ���տ�����CO2�����ܶɳ�����ʱ�����й�ϵ��˵����ȷ���� ��
����������䡱��С��������̼�����Һ���տ�����CO2�����ܶɳ�����ʱ�����й�ϵ��˵����ȷ���� ��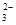 ��+c��HCO
��+c��HCO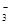 ��+c��H2CO3��
��+c��H2CO3�� c��CO
c��CO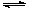 CH3OH��g��+ H2O��g�� ��H<0��CH3OH��Ũ����ʱ��仯��ͼ���ش��й����⣺
CH3OH��g��+ H2O��g�� ��H<0��CH3OH��Ũ����ʱ��仯��ͼ���ش��й����⣺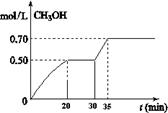
 Na2S4 + 3NaBr���øõ��Ϊ��Դ������������ˮ��Һ������ʽ��е�⣬ʹCO2��ͭ�缫�Ͽ�ת��Ϊ���顣
Na2S4 + 3NaBr���øõ��Ϊ��Դ������������ˮ��Һ������ʽ��е�⣬ʹCO2��ͭ�缫�Ͽ�ת��Ϊ���顣
 N2O4(��ɫ) ��H��0��Ӧ��NO2��N2O4�����ʵ����淴Ӧʱ��仯����������ͼ��������Ҫ������
N2O4(��ɫ) ��H��0��Ӧ��NO2��N2O4�����ʵ����淴Ӧʱ��仯����������ͼ��������Ҫ������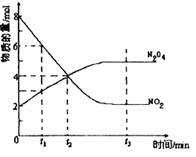
 2SO3(g�� ��H����196 kJ?mol��1����һ���̶��ݻ�Ϊ5 L���ܱ������г���0.20 mol SO2��0.10 mol O2������Ӻ�ﵽƽ�⣬��������к�SO3Ϊ0.18 mol����v(O2)���� ��mol?L��1?min��1���ų�������Ϊ�� �� kJ��
2SO3(g�� ��H����196 kJ?mol��1����һ���̶��ݻ�Ϊ5 L���ܱ������г���0.20 mol SO2��0.10 mol O2������Ӻ�ﵽƽ�⣬��������к�SO3Ϊ0.18 mol����v(O2)���� ��mol?L��1?min��1���ų�������Ϊ�� �� kJ�� 
 cC(g)��dD(g)����H��Q���Ը���ͼ�ش�
cC(g)��dD(g)����H��Q���Ը���ͼ�ش�
