题目内容
一定温度下,在溶剂为1L的密闭容器内放入2molN2O4和8molNO2,发生如下反应2 NO2(红棕色) N2O4(无色) △H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色) △H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答: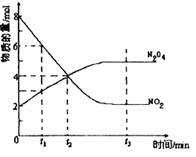
(1)在该温度下,反应的化学平衡常数表达式为: 。
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol· L-1· s-1。
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答: 。
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率。
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动(填“正反应方向”、“逆反应方向”或“不变”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色 (填“变深”、“变浅”或“不变”)。
⑴K=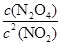 ⑵0.1 ⑶t3 ⑷> ⑸正反应方向 ⑹变深
⑵0.1 ⑶t3 ⑷> ⑸正反应方向 ⑹变深
解析试题分析:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,因此可逆反应2NO2 N2O4的平衡常数表达式K=
N2O4的平衡常数表达式K=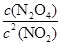 。
。
(2)由图可知,从t1至t2时N2O4的物质的量变化量为4mol-3mol=1mol,其浓度变化量为1mol/L,时间是20s-10s=10s,所以故v(N2O4)=1mol/L÷10s=0.1mol/(L?s)。
(3)到达平衡时,反应混合物各组分的物质的量不发生变化,由图象可知,t3时刻处于平衡状态,故答案为:t3。
(4)t1时刻后,NO2浓度降低,N2O4浓度增大,未到达平衡状态,反应向正反应进行,故正反应速率大于逆反应速率,故答案为:>。
(5)维持容器的温度不变,缩小容器的体积,压强增大,平衡向体积减小的方向移动,即向正反应方向移动,故答案为:正反应方向。
(6)维持容器的体积不变,升高温度,平衡向逆反应移动,NO2浓度增大,混合气体颜色变深,故答案为:变深。
考点:考查化学平衡图象、化学平衡常数、反应速率计算、化学平衡的影响因素等

Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出大试管中发生反应的化学方程式: ,该反应是 反应(填放热或吸热)。
(2)实验结果表明,催化剂的催化效果与 有关。
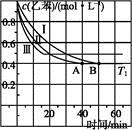
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行, 在从0—3分钟各物质的量的变化情况如图所示(A,B,C均为气体)。
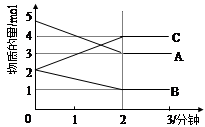
(3)该反应的的化学方程式为 ;
(4)反应开始至2分钟时,B的平均反应速率为 。
(5)能说明该反应已达到平衡状态的是 。
a.v(A)= 2v(B) b.容器内压强保持不变
c.v逆(A)= v正(C) d.容器内混合气体的密度保持不变
(6)由图求得A的平衡时的转化率为 。
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ·mol-1一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)
A.容器中的压强不变
B.1 mol H—H键断裂的同时断裂2 mol H—O键
C.v正(CO)=v逆(H2O)
D.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实 验 组 | 温 度 /℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①该反应的逆反应为 (填“吸”或“放”)热反应。
②若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3 min,则a、b应满足的关系是 (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g) +H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2, 下列措施中能使 c(CH3OH)增大的是
CH3OH(g) +H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2, 下列措施中能使 c(CH3OH)增大的是 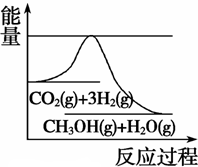
A.升高温度
B.充入N2(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入0.5 mol CO2和1.5 mol H2
碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32- 2I-+ S4O62-(快)
2I-+ S4O62-(快)
向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx mL,理由是 。
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)

碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:2Li(s)+I2(s)
 2LiI(s)ΔH
2LiI(s)ΔH已知:①4Li(s)+O2(g)
 2Li2O(s) ΔH1 ②4LiI(s)+O2(g)
2Li2O(s) ΔH1 ②4LiI(s)+O2(g) 2I2(s)+2Li2O(s)ΔH2
2I2(s)+2Li2O(s)ΔH2则电池反应的ΔH= ;碘电极作为该电池的 极。
700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1),下列说法正确的是
CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1),下列说法正确的是
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
A.反应在t1min内的平均速率为v(H2)=
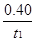 mol·L-1·min-1
mol·L-1·min-1B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
 CH3OCH3(g) + H2O(g)。已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2) / n(CO)]的变化曲线如下左图:
CH3OCH3(g) + H2O(g)。已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2) / n(CO)]的变化曲线如下左图: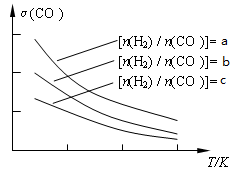
 xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白: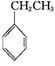 (g)+CO2(g)
(g)+CO2(g)
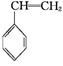 (g)+CO(g)+H2O(g)ΔH="-166" kJ·mol-1
(g)+CO(g)+H2O(g)ΔH="-166" kJ·mol-1