题目内容
18.某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl,下列说法正确的是( )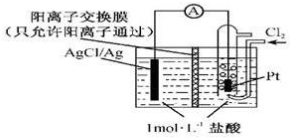
| A. | 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 正极反应为Ag-e-=Ag+ | |
| D. | 用KCl溶液代替盐酸,则电池总反应随之改变 |
分析 根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A.放电时,当电路中转移0.01mol e-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动;
B.放电时,交换膜左侧的氢离子向右侧移动,银离子在左侧生成AgCl沉淀;
C.正极上氯气得电子发生还原反应;
D.根据电池总反应为2Ag+Cl2═2AgCl可知,用KCl溶液代替盐酸,电池的总反应不变.
解答 解:根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A.放电时,当电路中转移0.01mol e-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,有0.01mol氯离子反应生成AgCl白色沉淀,所以交换膜左侧溶液中约减少0.02 mol离子,故A正确;
B.放电时,交换膜左侧的氢离子向右侧移动,在负极上有银离子生成,银离子在左侧和氯离子反应生成AgCl沉淀,故B错误;
C.正极上氯气得电子发生还原反应,正极反应式为Cl2+2e-═2Cl-,故C错误;
D.根据电池总反应为2Ag+Cl2═2AgCl可知,用KCl溶液代替盐酸,电池的总反应不变,故D错误;
故选A.
点评 本题考查化学电源新型电池,为高频考点,明确各个电极上发生的反应是解本题关键,易错选项是AB,注意AgCl在左侧生成而不是右侧生成,左侧有一部分氢离子转移到右侧、有一部分氯离子参加反应生成沉淀,为易错点.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 煤的主要组成为苯以及苯的同系物 | |
| B. | “可燃冰”为水可能变成油提供了有力的证据 | |
| C. | 油脂、淀粉、纤维素、蛋白质都是高分子化合物 | |
| D. | 石油的裂解是使石油分馏产物中的长链烃断裂成乙烯、丙烯等气态短链烃 |
6.已知维生素A的结构简式如图.关于它的叙述正确的是( )


| A. | 维生素A的分子式为C20H30O | |
| B. | 1 mol维生素A最多可与 7 mol H2发生加成反应 | |
| C. | 维生素A分子中含有羟基、碳碳双键和苯环等官能团 | |
| D. | 维生素A是一种易溶于水的醇 |
13.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 电解精炼铜时,粗铜与电源正极相连 | |
| B. | 在海轮外壳上镶入锌块,是牺牲阳极的阴极保护法 | |
| C. | 用Na2S作沉淀剂,除去废水中Cu2+和Hg2+ | |
| D. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
10.下列离子组能大量共存的是( )
| A. | K+、H+、SO42-、OH- | B. | Na+、Mg2+、OH-、NO3- | ||
| C. | Na+、H+、CO32-、Fe2+ | D. | Mg2+、Cu2+、Cl-、SO42- |
8.下列叙述正确的是( )
| A. | 0.1mol/L CH3COONa溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | Na2CO3溶液加水稀释后,恢复至原温度,pH增大和KW不变 | |
| C. | 一定温度下,pH=6的HCl溶液和pH=6的NH4Cl溶液中,c(H+)相等 | |
| D. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)不变化 |
 三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.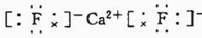 .
.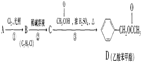 )对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业.它有很多同分异构体,其中含有酯基和一取代苯结构的同分异构体有五个,请写出其结构简式:
)对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业.它有很多同分异构体,其中含有酯基和一取代苯结构的同分异构体有五个,请写出其结构简式: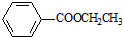 、
、 、
、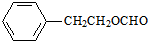 、
、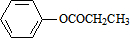 、
、 .
.