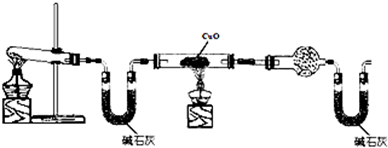
题目内容
9.写出下列反应的热化学方程式(1)在25℃、101kPa时,1g CH4完全燃烧生成液态水时放出的热量是55.6kJ,则CH4燃烧生成液态水的热化学方程式是CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ/mol.
已知:H2O(g)═H2O(l)△H=-44kJ•mol-1,则CH4燃烧生成气态水的热化学方程式是CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-801.6KJ/mol.
(2)已知氢气中H-H键能为436kJ•mol-1,氯气中Cl-Cl键能为243kJ•mol-1,氯化氢气体中H-Cl键能为431kJ•mol-1,写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式:H2(g)+Cl2(g)=2HCl(g)△H=-183.0kJ•mol-1.
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-354.8 kJ/mol.
分析 (1)计算1mol甲烷完全燃烧生成液态水放出的热量,注明物质的聚集状态与反应热书写热化学方程式;
根据盖斯定律书写生成气态水的热化学方程式;
(2)反应热=反应物总键能-生成物总键能,注明物质的聚集状态与反应热书写热化学方程式;
(3)已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
由盖斯定律,(①-②)×$\frac{1}{2}$可得:CH3OH(l)+O2(g)=CO (g)+2H2O(l),反应热也进行相应的计算.
解答 解:(1)1molCH4在氧气中燃烧生成CO2和液态水,放出热量为55.6kJ×$\frac{1mol×16g/mol}{1g}$=889.6kJ热量,
则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ/mol,
由:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ/mol,
②H2O(g)═H2O(l)△H=-44kJ•mol-1,
根据盖斯定律,①-②×2可得:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-801.6KJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ/mol;
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-801.6KJ/mol;
(2)发生反应:H2(g)+Cl2(g)=2HCl(g),△H=(436kJ•mol-1+243kJ•mol-1)-2×(431kJ•mol-1)=-183.0kJ•mol-1,反应热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H=-183.0kJ•mol-1,
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-183.0kJ•mol-1;
(3)已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
由盖斯定律,(①-②)×$\frac{1}{2}$可得:CH3OH(l)+O2(g)=CO (g)+2H2O(l),故△H=$\frac{1}{2}$[(-1275.6kJ/mol)-(-556.0kJ/mol)]=-354.8 kJ/mol,故甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-354.8 kJ/mol,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-354.8 kJ/mol.
点评 本题考查热化学方程式书写,涉及盖斯定律的运用、反应热计算等,难度不大.

| A. | 一定相等 | B. | 一定不相等 | C. | 不一定相等 | D. | 不能确定 |
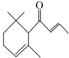 一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构简式如图.有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构简式如图.有关该化合物的下列说法不正确的是( )| A. | 分子式为C13H20O | |
| B. | 该化合物可发生加聚反应 | |
| C. | 1 mol该化合物完全燃烧消耗18molO2 | |
| D. | 该物质能使溴水和酸性KMnO4溶液褪色 |
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能∕(kJ•mol-1) | 436 | 243 | 431 |
| A. | 0.5 H2(g)+0.5 Cl2(g)═HCl(g)△H=-91.5 kJ•mol-1 | |
| B. | H2(g)+Cl2(g)═2HCl(g)△H=-183 kJ•mol-1 | |
| C. | 0.5 H2(g)+0.5 Cl2(g)═HCl(g)△H=+91.5 kJ•mol-1 | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H=+183 kJ•mol-1 |
| A. | 乙醇汽油是一种纯净物 | |
| B. | 乙醇汽油作燃料不会产生碳氧化物等有害气体,其优点是可以减少对环境的污染 | |
| C. | 乙醇和汽油都可作溶剂,也可相互溶解 | |
| D. | 乙醇和乙二醇互为同系物 |

 .
. .
. .
.