题目内容
下列离子方程式中不正确的是
- A.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
- B.碘化钾溶液跟适量溴水反应:2I-+Br2=I2+2Br-
- C.将金属钠加入水中:Na+2H2O=Na++2OH-+H2↑
- D.将氯气通入氯化亚铁溶液中2Fe2++Cl2=2Fe3++2Cl-
AC
分析:A、碳酸氢钙是一种可溶于水的盐,能完全电离;
B、单质溴的氧化性强于单质碘,可以将碘从其盐中置换出来;
C、离子方程式要遵循电荷守恒思想;
D、氯气有强氧化性,亚铁离子具有还原性,氯气能将亚铁离子氧化.
解答:A、碳酸氢钙是一种可溶于水的盐,应该写成离子的形式,应为:HCO3-+H+=H2O+CO2↑,故A错误;
B、单质溴的氧化性强于单质碘,可以将碘从其盐中置换出来,离子方程式为:2I-+Br2=I2+2Br-,故B正确;
C、反应前后电荷不守恒,应为:2Na+2H2O=2Na++2OH-+H2↑,故C错误;
D、氯气有强氧化性,亚铁离子具有还原性,氯气能将亚铁离子氧化为最高价,方程式为:2Fe2++Cl2=2Fe3++2Cl-,故D正确.
故选AC.
点评:本题考查学生离子方程式的正误判断,是现在高考的热点考题.
分析:A、碳酸氢钙是一种可溶于水的盐,能完全电离;
B、单质溴的氧化性强于单质碘,可以将碘从其盐中置换出来;
C、离子方程式要遵循电荷守恒思想;
D、氯气有强氧化性,亚铁离子具有还原性,氯气能将亚铁离子氧化.
解答:A、碳酸氢钙是一种可溶于水的盐,应该写成离子的形式,应为:HCO3-+H+=H2O+CO2↑,故A错误;
B、单质溴的氧化性强于单质碘,可以将碘从其盐中置换出来,离子方程式为:2I-+Br2=I2+2Br-,故B正确;
C、反应前后电荷不守恒,应为:2Na+2H2O=2Na++2OH-+H2↑,故C错误;
D、氯气有强氧化性,亚铁离子具有还原性,氯气能将亚铁离子氧化为最高价,方程式为:2Fe2++Cl2=2Fe3++2Cl-,故D正确.
故选AC.
点评:本题考查学生离子方程式的正误判断,是现在高考的热点考题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 I 取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该试验,下列说法正确的是
I 取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该试验,下列说法正确的是
 bM(g),M、N的物质的量随时间的变化曲线如右图所示:
bM(g),M、N的物质的量随时间的变化曲线如右图所示: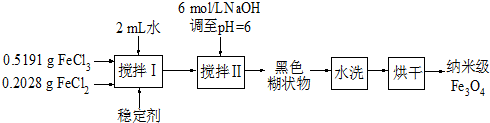

 A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.
A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示. 研究化学反应原理对于生产、生活及环境保护具有重要意义.
研究化学反应原理对于生产、生活及环境保护具有重要意义.