题目内容
(2010?扬州模拟)实验室用共沉淀法制备纳米级Fe3O4的流程如下: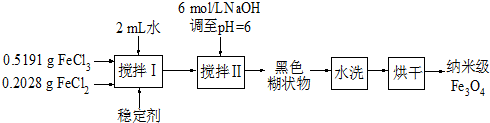
该方法的关键为促进晶粒形成,并控制晶体生长.试回答下列问题:
(1)该反应原理的离子方程式可表示为
(2)反应温度需控制在50℃,其方法是
(3)在搅拌Ⅱ的过程中还需加入10mL正丙醇,其作用是
(4)黑色糊状物转移至烧杯中,用倾析法洗涤,检验洗净的操作是
(5)由上述分析可知,影响纳米级Fe3O4粒径大小的因素有(写出一条)

该方法的关键为促进晶粒形成,并控制晶体生长.试回答下列问题:
(1)该反应原理的离子方程式可表示为
Fe2++2Fe3++8OH-=Fe3O4+4H2O
Fe2++2Fe3++8OH-=Fe3O4+4H2O
.(2)反应温度需控制在50℃,其方法是
水浴加热
水浴加热
,温度偏低造成产量低的可能是温度低时反应缓慢
温度低时反应缓慢
.(3)在搅拌Ⅱ的过程中还需加入10mL正丙醇,其作用是
降低Fe3O4的溶解度(使其易达到饱和,促进晶粒形成)
降低Fe3O4的溶解度(使其易达到饱和,促进晶粒形成)
.(4)黑色糊状物转移至烧杯中,用倾析法洗涤,检验洗净的操作是
取最后的倾出液,测其pH为中性(或滴加KSCN,不变血红色或加入经稀硝酸酸化的硝酸银溶液不产生沉淀),则已洗净.
取最后的倾出液,测其pH为中性(或滴加KSCN,不变血红色或加入经稀硝酸酸化的硝酸银溶液不产生沉淀),则已洗净.
.(5)由上述分析可知,影响纳米级Fe3O4粒径大小的因素有(写出一条)
反应温度(或溶液的pH、稳定剂用量、铁盐的比例(浓度)、搅拌速度、溶剂的配比等)
反应温度(或溶液的pH、稳定剂用量、铁盐的比例(浓度)、搅拌速度、溶剂的配比等)
.分析:(1)依据流程图分析制备反应过程,是氯化铁、氯化亚铁在氢氧化钠溶液中生成四氧化三铁、水、氯化钠;根据电荷守恒可写出该方程式;
(2)反应条件温度低于100°C,需要用水浴加热,水浴加热温度容易控制,加热均匀;温度低影响反应速率;
(3)在搅拌Ⅱ的过程中还需加入10mL正丙醇,使其易达到饱和,促进晶粒形成;
(4)水洗的主要作用是洗去吸附在黑色糊状物表面的Fe3+和Cl-,只要检验其中一个不存在即可;
(5)由上述分析可知,影响纳米级Fe3O4粒径大小的因素,可根据流程中的信息分析判断.
(2)反应条件温度低于100°C,需要用水浴加热,水浴加热温度容易控制,加热均匀;温度低影响反应速率;
(3)在搅拌Ⅱ的过程中还需加入10mL正丙醇,使其易达到饱和,促进晶粒形成;
(4)水洗的主要作用是洗去吸附在黑色糊状物表面的Fe3+和Cl-,只要检验其中一个不存在即可;
(5)由上述分析可知,影响纳米级Fe3O4粒径大小的因素,可根据流程中的信息分析判断.
解答:解:(1)由流程可知,生成Fe3O4的反应物为Fe2+、Fe3+和OH-,根据电荷守恒可写出该方程式为:Fe2++2Fe3++8OH-=Fe3O4+4H2O,
故答案为:Fe2++2Fe3++8OH-=Fe3O4+4H2O;
(2)低于100℃的温度控制通常用水浴加热法,温度低对速率和平衡都会造成影响,但本题中未涉及平衡,所以应是速率降低,
故答案为:水浴加热;温度低时反应缓慢;
(3)由流程可看出搅拌Ⅰ的作用是使物质混合均匀,搅拌Ⅱ的作用则是加快反应速率,使之反应充分,加入正丙醇,作用为降低Fe3O4的溶解度;
故答案为:降低Fe3O4的溶解度;
(4)把沉淀上部的溶液倾入另一容器内,然后往盛着沉淀的容器内加入少量洗涤液,充分搅拌后,沉降,倾去洗涤液.如此重复操作3遍以上,即可把沉淀洗净,使沉淀与溶液分离.水洗的主要作用是洗去吸附在黑色糊状物表面的Fe3+和Cl-,只要检验其中一个不存在即可,取最后的倾出液,测其pH为中性(或滴加KSCN,不变血红色或加入经稀硝酸酸化的硝酸银溶液不产生沉淀),则已洗净,
故答案为:取最后的倾出液,测其pH为中性(或滴加KSCN,不变血红色或加入经稀硝酸酸化的硝酸银溶液不产生沉淀),则已洗净;
(5)流程中涉及到反应温度、溶液的pH、稳定剂用量等对产物纳米级Fe3O4粒径大小有影响,
故答案为:反应温度(或溶液的pH、稳定剂用量、铁盐的比例(浓度)、搅拌速度、溶剂的配比等).
故答案为:Fe2++2Fe3++8OH-=Fe3O4+4H2O;
(2)低于100℃的温度控制通常用水浴加热法,温度低对速率和平衡都会造成影响,但本题中未涉及平衡,所以应是速率降低,
故答案为:水浴加热;温度低时反应缓慢;
(3)由流程可看出搅拌Ⅰ的作用是使物质混合均匀,搅拌Ⅱ的作用则是加快反应速率,使之反应充分,加入正丙醇,作用为降低Fe3O4的溶解度;
故答案为:降低Fe3O4的溶解度;
(4)把沉淀上部的溶液倾入另一容器内,然后往盛着沉淀的容器内加入少量洗涤液,充分搅拌后,沉降,倾去洗涤液.如此重复操作3遍以上,即可把沉淀洗净,使沉淀与溶液分离.水洗的主要作用是洗去吸附在黑色糊状物表面的Fe3+和Cl-,只要检验其中一个不存在即可,取最后的倾出液,测其pH为中性(或滴加KSCN,不变血红色或加入经稀硝酸酸化的硝酸银溶液不产生沉淀),则已洗净,
故答案为:取最后的倾出液,测其pH为中性(或滴加KSCN,不变血红色或加入经稀硝酸酸化的硝酸银溶液不产生沉淀),则已洗净;
(5)流程中涉及到反应温度、溶液的pH、稳定剂用量等对产物纳米级Fe3O4粒径大小有影响,
故答案为:反应温度(或溶液的pH、稳定剂用量、铁盐的比例(浓度)、搅拌速度、溶剂的配比等).
点评:本题考查了制备实验的设计,流程分析判断,反应条件的应用,实验基本操作的迁移应用能力,解答此类题的关键是一定要注意题中所给的信息,题目难度中等.

练习册系列答案
相关题目
