题目内容
【题目】利用如图所示装置测定中和热的实验步骤如下:①用量筒量取50 mL 0.50 mol·L1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
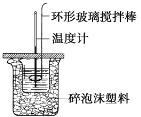
(1)使盐酸与NaOH溶液混合均匀的正确操作是___(填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动。
(2)倒入NaOH溶液的正确操作是_____(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)为什么所用NaOH溶液要稍过量?________。
(4)现将一定量的稀氢氧化钠溶液、浓氢氧化钙溶液、稀氨水分别和1 L 1 mol·L1的稀盐酸恰好完全反应,其热量分别为Q1、Q2、Q3,则Q1、Q2、Q3的大小关系为_______。
【答案】D C 确保盐酸被完全中和 Q2>Q1>Q3
【解析】
(1)盐酸和氢氧化钠混合时,用套在温度计上的环形玻璃搅拌棒轻轻地搅动,使盐酸与NaOH溶液混合均匀;
(2)将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失,影响测定结果;
(3)为了确保定量的盐酸反应充分,所用NaOH稍过量;
(4)中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,弱电解质存在电离平衡,电离过程是吸热过程,据此分析作答;
(1) 使盐酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;
故答案为:D;
(2)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
故答案为:C;
(3) 实验中,所用NaOH稍过量的原因是确保定量的盐酸反应完全,
故答案为:确保盐酸被完全中和;
(4)中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,一定量的稀氢氧化钠溶液、1 L 1molL1的稀盐酸恰好完全反应放热为57.3kJ; 浓氢氧化钙溶液溶于水放出部分热量,则1 L 1 mol·L1的稀盐酸恰好完全反应放热大于57.3kJ;一水合氨是弱电解质,存在电离平衡,电离过程是吸热程,稀氨水和1 L 1molL1的稀盐酸恰好完全反应放热小于57.3kJ,故Q2>Q1>Q3。