��Ŀ����
����Ŀ�����仯������ʳƷ����֯��ҽҩ�����յ�����Ӧ�ù㷺��
(1)�黯����һ����Ҫ�İ뵼����ϡ���(Ga)����ͬ�壬�ص�ԭ�ӽṹʾ��ͼΪ____��
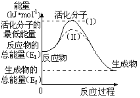
(2)B2H6(�����飩����ȼ����ֵ�ߣ���δ���ĸ���ȼ�ϣ����ڻ���͵�����1molB2H6(g)��O2(g)��ȼ�գ�����B2O3(s)��H2O(g)�ų�2033.8kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ__________��
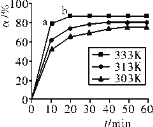
(3)������������ͬʱ����ӦH3BO3+3CH3OH![]() B(OCH3)3+3H2O�У�H3BO3��ת����(a)�ڲ�ͬ�¶����淴Ӧʱ��(t)�ı仯��ͼ���ɴ�ͼ�ɵó���
B(OCH3)3+3H2O�У�H3BO3��ת����(a)�ڲ�ͬ�¶����淴Ӧʱ��(t)�ı仯��ͼ���ɴ�ͼ�ɵó���
�ٸ÷�Ӧ����H_______0(����<��=������>����������H3BO3�����ʣ�va(�棩_______vb(��))(����<����=������>������
�ڸ��ݻ�ѧ��Ӧԭ�������������¶ȶ��Ʊ�B(OCH3)3��Ӧ��Ӱ��_______��
����Ҫ��һ����������ת���ʣ����˿����ʵ��ı䷴Ӧ�¶��⣬�����Բ�ȡ�Ĵ�ʩ�У�_______��
(4)H3BO3��Һ�д������·�Ӧ��H3BO3(aq) +H2O(l)=[B(OH)4]-(aq)+H+(aq)������ʱ����֪0.70molL-1H3BO3��Һ�У�ƽ��(H+)=2.0��10-5molL-1��ˮ�ĵ���ɺ��Բ��ƣ���ʽ����÷�Ӧ��ƽ�ⳣ��KԼΪ_______(������������λ��Ч���֣���
���𰸡�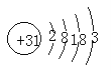 B2H6(g)+3O2(g)=B2O3(s)+3H2O(g) ��H=-2033.8kJ/mol �� �� �����¶ȣ���Ӧ���ʼӿ죻ͬʱƽ�������ƶ���B(OCH3)3������� �����B(OCH3)3�����Ӽ״���Ũ�ȣ����� 5.7��10-10mol/L
B2H6(g)+3O2(g)=B2O3(s)+3H2O(g) ��H=-2033.8kJ/mol �� �� �����¶ȣ���Ӧ���ʼӿ죻ͬʱƽ�������ƶ���B(OCH3)3������� �����B(OCH3)3�����Ӽ״���Ũ�ȣ����� 5.7��10-10mol/L
��������
(1)����ԭ�Ӻ�������Ų�������дԭ�ӽṹʾ��ͼ��
(2)���ݷ�Ӧ�����ʵ����ʵ��������ʵĴ���״̬����Ӧ�ͷŵ�������д�Ȼ�ѧ����ʽ��
(3)�ٸ��ݲ�ͬ�¶���H3BO3��ƽ��ת����(a)��С������������Ũ�ȶԷ�Ӧ���ʵ�Ӱ���ж�a��b����ķ�Ӧ���ʴ�С��
�ڴ��¶ȶԷ�Ӧ���ʵ�Ӱ��÷�Ӧ������ӦΪ���ȷ�Ӧ������
�۴ӻ�ѧƽ��Ӱ�����ط���ѡ������������
(4)����ƽ�ⳣ���ĺ������K��
(1)Ga�ǵ������ڵ�IIIA��Ԫ�أ�ԭ��������31��ԭ�Ӻ����������3�����ӣ���ԭ�ӽṹʾ��ͼΪ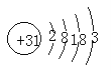 ��
��
(2) 1molB2H6(g)��O2(g)��ȼ�գ�����B2O3(s)��H2O(g)�ų�2033.8kJ����������÷�Ӧ���Ȼ�ѧ����ʽΪB2H6(g)+3O2(g)=B2O3(s)+3H2O(g) ��H=-2033.8kJ/mol��
(3)�ٸ���ͼʾ��֪�������¶�H3BO3��ƽ��ת����(a)����˵�������¶ȣ���Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����÷�Ӧ������ӦΪ���ȷ�Ӧ��������H>0��
a�㷴Ӧδ�ﵽƽ�⣬��Ӧ������У�b�㷴Ӧ�ﵽƽ��״̬�����ŷ�Ӧ�Ľ��У�������Ũ��������v��������v����С����b��ʱ�淴Ӧ����������v��=v�������Է�Ӧ����va(�棩<vb(��)��
�������¶ȣ���Ӧ���ʼӿ죻ͬʱ���ڸ÷�Ӧ������Ӧ�����ȷ�Ӧ�������¶ȣ���ѧƽ�������ƶ���ʹB(OCH3)3������ߣ�
�۷�Ӧ��H3BO3+3CH3OH![]() B(OCH3)3+3H2O����ӦΪ���ȷ�Ӧ����Ҫ��һ����������ת���ʣ����˿����ʵ��ı䷴Ӧ�¶��⣬�����Բ�ȡ�����B(OCH3)3�����Ӽ״���Ũ��(��)�ȴ�ʩ�ﵽĿ�ģ�
B(OCH3)3+3H2O����ӦΪ���ȷ�Ӧ����Ҫ��һ����������ת���ʣ����˿����ʵ��ı䷴Ӧ�¶��⣬�����Բ�ȡ�����B(OCH3)3�����Ӽ״���Ũ��(��)�ȴ�ʩ�ﵽĿ�ģ�
(4)��ӦH3BO3(aq) +H2O(l)![]() [B(OH)4]-(aq)+H+(aq)�ﵽƽ��ʱ���������ʱ仯��ϵ��֪ƽ��ʱc([B(OH)4]-)=c(H+)=2.0��10-5mol/L��c(H3BO3)=0.70mol/L-2.0��10-5mol/L=0.70mol/L������K=
[B(OH)4]-(aq)+H+(aq)�ﵽƽ��ʱ���������ʱ仯��ϵ��֪ƽ��ʱc([B(OH)4]-)=c(H+)=2.0��10-5mol/L��c(H3BO3)=0.70mol/L-2.0��10-5mol/L=0.70mol/L������K=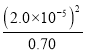 mol/L =5.7��10-10mol/L��
mol/L =5.7��10-10mol/L��

����Ŀ����֪������Ũ��Ϊ0.1mol��L-1��������Һ��pH���±���
���� | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
�����й�˵����ȷ����
A. ����ͬ�¶��£�ͬŨ�ȵ���������Һ�ĵ�������˳��H2CO3<HClO<HF
B. ����CO2ͨ��0.1 mol��L-1Na2CO3��Һ������Һ���ԣ�����Һ��2c(CO32-)+c(HCO3-)=0.1 mol��L-1
C. �����ϱ���ˮ�ⷽ��ʽClO-+H2O![]() HClO+OH-��ˮ�ⳣ��K=10-7.6
HClO+OH-��ˮ�ⳣ��K=10-7.6
D. ������NaClO��Һ��ͨHF������ǡ����ȫ��Ӧʱ��c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-)