��Ŀ����
����Ŀ��NaBiO3����Ϊ���������вⶨ�̵���������Bi2O3�ڵ�����ҵ���Ź㷺Ӧ�ã������ø�ѡ���Ļ����(��Ҫ�ɷ���Bi2S3����������SiO2������)���Ʊ����乤����������:
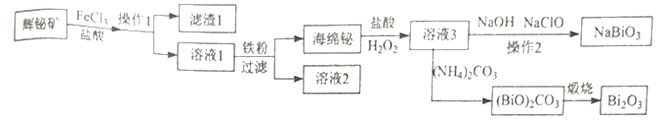
�ش���������:
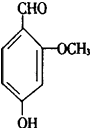
��1��������������Һ������Ԫ����Ҫ��Bi3+��ʽ���ڣ�д��Bi2S3��FeCl3 ��Һ��Ӧ�����ӷ���ʽ:_____________________���������ᣬ�ȿ������Ľ����ʣ��ֿ�_____________________������1����Ҫ�ɷ���_____����
��2��NaBiO3 ��Ϊ����������γ���֮һ������Һ3 �Ƶô�����NaBiO3������2 ����_________��
��3�� Bi2O3 ��Na2O2 ��������״̬�·�Ӧ�Ƶ�NaBiO3���丱����Ϊ____________________��
��4��д�������������ɼ�ʽ̼����[(BiO)2CO3]�Ʊ�Bi2O3�Ļ�ѧ����ʽ:_____________________��
��5�� ij������m1 kg �����(��Bi2O360%)�Ʊ�NaBiO3�����յõ���Ʒm2kg������Ϊ_________��
���𰸡� Bi2S3+6Fe3��=2Bi3��+6Fe2��+3S ������Һ��Bi3����ˮ�� SiO2 ���ˡ�ϴ�ӡ����� Na2O (BiO)2CO3![]() Bi2O3��CO2��
Bi2O3��CO2�� ![]()
���������������:��������Ϣ��֪��������Ȼ���������Ļ��Һ��ȡ�������е������ӱ�����Ϊ���ʣ����˺��ȥ����������������������Һ�м������������۰����û������õ������飬�����龭�����˫��ˮ�ܽ�õ��Ȼ�����Һ�����Ȼ�����Һ�м�������������Һ�ʹ���������Һ���Ȼ�������Ϊ�����ƣ����Ȼ�����Һ�м���̼��刺�������̼�����������̼�����龭���յõ������顣
��1��������������Һ������Ԫ����Ҫ��Bi3+��ʽ���ڣ� Bi2S3��FeCl3��Һ��Ӧ�����ӷ���ʽΪBi2S3+6Fe3��=2Bi3��+6Fe2��+3S���������ᣬ�ȿ������Ľ����ʣ��ֿ�������Һ��Bi3����ˮ�⣻����1����Ҫ�ɷ���SiO2����
��2����������Ϣ��֪��NaBiO3������ˮ������Һ3�����ɵ������Ƴ����辭���ˡ�ϴ�ӡ����﷽���Ƶô�����NaBiO3��
��3��Bi2O3��Na2O2��������״̬�·�Ӧ�Ƶ�NaBiO3��Bi�Ļ��ϼ����ߣ����ݻ��ϼ۵��������ɣ������ƶ�O�Ļ��ϼ���-1���͵�-2�����丱����ΪNa2O��
��4�� �����������ɼ�ʽ̼����[(BiO)2CO3]�Ʊ�Bi2O3�Ļ�ѧ����ʽ(BiO)2CO3![]() Bi2O3��CO2����
Bi2O3��CO2����
��5��m1kg�����Bi2O3������Ϊ0.6m1kg��������ȫת��ΪNaBiO3�����Եõ�NaBiO3������Ϊ![]() kg=
kg=![]() kg�����յõ���Ʒm2kg���ʲ���Ϊ
kg�����յõ���Ʒm2kg���ʲ���Ϊ ��
��

 ����ʦ���һ��һ��ϵ�д�
����ʦ���һ��һ��ϵ�д�����Ŀ�����û�ѧԭ�����ԶԹ����ŷŵķ�ˮ�������Ƚ�����Ч��������������ij�������Ƹ﹤ҵ������Cr(III)�Ĵ��������������£�
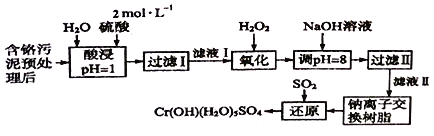
��֪��
�������ȡҺ�еĽ���������Ҫ��Cr3+�������Fe3+��Al3+��Ca2+��Mg2+��
�ڳ����£�����������������������ʽ����ʱ��Һ��pH���£�
������ | Fe3+ | Mg2+ | Al3+ | Cr3+ |
������ȫʱ��pH | 3.7 | 11.1 | 5.4(��8�ܽ�) | 9(��9�ܽ�) |
(1)���ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��_________________(д������)��
(2)���˲���ʱ���ò����������ձ��⣬����Ҫ________________��
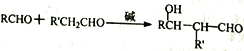
(3)H2O2�������ǽ���ҺI�е�Cr3+ת��ΪC2O72-���÷�Ӧ�����ӷ���ʽΪ��____________________��
(4)����NaOH��Һ������ҺpH=8���ȿ���ʹ��Һ��ijЩ��������ת��Ϊ������ͬʱ�ֿ��Խ�Cr2O72-ת��Ϊ________(�����Ļ�ѧʽ)������Һ��pH>8ʱ����������Ҫ�ɷ�Ϊ________ (�ѧʽ)��
(5)�����ӽ�����֬�ķ�Ӧԭ��Ϊ��Mn++nNaR=MRn+nNa+�������������ӽ�����֬�ɳ�ȥ��Һ���еĽ�����������________________����������Һ��Ũ���������������Ϊ________________��