题目内容
(8分)已知某饱和氯化钠溶液体积为VmL,溶液密度为d g·cm-3,溶质的质量分数为ω%,物质的量浓度为c mol·L-1,溶液中含NaCl的质量为m g。
(1)用ω表示该温度下NaCl的溶解度是 。
(2)用m、V表示溶液的物质的量浓度是 。
(3)用ω、d表示溶液的物质的量浓度是 。
(4)用c、d表示溶液中溶质的质量分数是 。
(1)用ω表示该温度下NaCl的溶解度是 。
(2)用m、V表示溶液的物质的量浓度是 。
(3)用ω、d表示溶液的物质的量浓度是 。
(4)用c、d表示溶液中溶质的质量分数是 。
(每空2分)(1)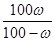 g (2)
g (2)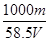 mol/L 或 17.1m/Vmol·L-1
mol/L 或 17.1m/Vmol·L-1
(3)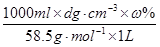 或0.171dωmol·L-1 (4)
或0.171dωmol·L-1 (4) 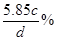
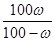 g (2)
g (2)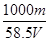 mol/L 或 17.1m/Vmol·L-1
mol/L 或 17.1m/Vmol·L-1(3)
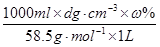 或0.171dωmol·L-1 (4)
或0.171dωmol·L-1 (4) 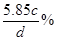
考查物质的量的有关计算。
(1)溶解度是在一定条件下,在100g水中溶解达到饱和时所能溶解的质量。由于饱和溶液中溶质的质量分数是ω%,所以溶解度S=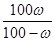 g。
g。
(2)溶液的体积是Vml,含有溶质氯化钠的质量是mg,物质的量是m/58.5mol,所以根据c=n/V可知,溶液的浓度是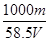 mol/L 或 17.1m/Vmol·L-1。
mol/L 或 17.1m/Vmol·L-1。
(3)根据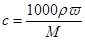 可知,溶液的浓度是
可知,溶液的浓度是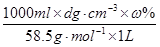 或0.171dωmol·L-1。
或0.171dωmol·L-1。
(4)溶液的质量是Vdg,而溶质的质量是0.001Vcmol,质量是0.001Vcmol×58.5g/mol=0.0585Vcg,所以溶质的质量分数是0.0585Vcg÷Vdg×100%=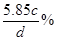
(1)溶解度是在一定条件下,在100g水中溶解达到饱和时所能溶解的质量。由于饱和溶液中溶质的质量分数是ω%,所以溶解度S=
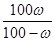 g。
g。(2)溶液的体积是Vml,含有溶质氯化钠的质量是mg,物质的量是m/58.5mol,所以根据c=n/V可知,溶液的浓度是
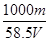 mol/L 或 17.1m/Vmol·L-1。
mol/L 或 17.1m/Vmol·L-1。(3)根据
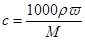 可知,溶液的浓度是
可知,溶液的浓度是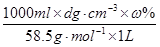 或0.171dωmol·L-1。
或0.171dωmol·L-1。(4)溶液的质量是Vdg,而溶质的质量是0.001Vcmol,质量是0.001Vcmol×58.5g/mol=0.0585Vcg,所以溶质的质量分数是0.0585Vcg÷Vdg×100%=
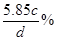

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目