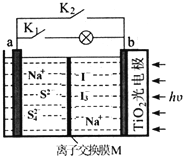
题目内容
【题目】某同学欲配制100mL 0.10molL﹣1的CuSO4溶液。以下操作1~5是其配制的过程及示意图:
操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解;
操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中;
操作3:继续向X中加蒸馏水至液面离X的刻度线l~2cm处;
操作4、操作5:见图
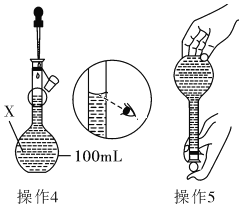
(1)仪器X的名称是______________;
(2)操作1中,应称取胆矾晶体的质量为_____________;
(3)若其余操作步骤均正确,根据操作4所配的溶液浓度__(选填“偏大”、“偏小”、“无影响”或“无法判断”)。
【答案】容量瓶 2.5g 偏小
【解析】
(1)依据仪器的形状说出其名称;
(2)依据n=cV、m=nM计算需要溶质的质量;
(3)操作4中仰视刻度线,依据c=n÷V进行误差分析。
(1)依据图中仪器形状可知X为100mL容量瓶;
(2)配制100mL 0.10molL-1的CuSO4溶液,需要硫酸铜的物质的量为:0.1L×0.10mol/L=0.01mol,需要五水硫酸铜的质量m=0.01mol×250g/mol=2.5g;
(3)操作4中仰视刻度线,则溶液体积偏大,依据c=n÷V可知,溶液浓度偏小。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目