题目内容
肼(N2H4)是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是
A.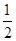 N2H4(g)+ N2H4(g)+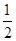 O2(g)=== O2(g)===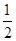 N2(g)+H2O(g) ΔH=+267 kJ·mol-1 N2(g)+H2O(g) ΔH=+267 kJ·mol-1 |
| B.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1 |
| C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 |
| D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1 |
C
解析试题分析:物质燃烧产生的热量的多少,不仅与物质的多少有关,还与物质的存在状态有关,所以写热化学方程式水要注意把物质的状态机相应的能量关系写明。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量,则1mol的N2H4(g)完全燃烧生成氮气和气态水时,放出534 kJ热量。所以该反应的热化学方程式是C.N2H4(g)+O2(g)===N2(g)+2H2O(g);ΔH=-534 kJ/mol.选项为C。
考点:考查热化学方程式的书写的知识。

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
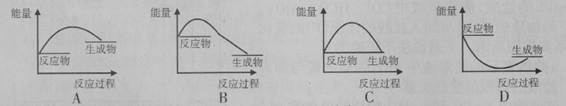
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
| A.该反应为放热反应 |
| B.催化剂能改变该反应的焓变 |
| C.催化剂能降低该反应的活化能 |
| D.逆反应的活化能大于正反应的活化能 |
根据下面信息,判断下列叙述中正确的是 ( )
| A.1molH2和0.5molO2所具有的总能量低于1mol气态H2O所具有的总能量 |
| B.氢气跟氧气反应生成水的同时吸收能量 |
| C.1molH2跟1/2molO2反应生成1molH2O(l)释放能量一定是245kJ |
| D.2molH2(g)跟1molO2(g)反应生成2molH2O(g)释放能量490kJ |
2013年6月11日我国成功发射了“神州十号”。这标志着中国人的太空时代又前进了一大步。发射“神十”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:
N2(g)+2O2(g)=2NO2(g);△H=+67.7 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534 kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
| A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7 kJ/mol |
| B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000.3 kJ/mol |
| C.N2H4(g)+NO2(g)=3/2N2(g)+2H2O(l);△H=-1135.7 kJ/mol |
| D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7 kJ/mol |
下列推论正确的是:
| A.S(g)+O2(g)==SO2(g)△H1;S(s)+O2(g)==SO2(g) △H2,则:△H1>△H2 |
| B.C(石墨,s)=C(金刚石,S)△H="+1.9" kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 |
| C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(I)△H=﹣57.4 kJ/mol,则:含20 gNaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ |
| D.2C(s)+O2(g)=2CO(g)△H=﹣221 kJ/mol,则碳的燃烧热等于110.5kJ/mol |
关于下列各图的叙述中不正确的是
| A.已知CO的燃烧热为283 kJ/mol,2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则图甲表示CO和H2O(g)生成CO2和H2的能量变化 |
| B.某温度下,pH=11的NH3·H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+ 、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05 mol·L-1 |
| C.在常温下,X2(g)和H2反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱 |
D.图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中, 的变化情况 的变化情况 |
已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44kJ的热量。其它相关数据如下表,则表中X为:
| | O=O(g) | H-H(g) | H-O(g) |
| 1mol化学键断裂时需要吸收的能量/kJ | 496 | X | 463 |

 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态