题目内容
下列推论正确的是:
| A.S(g)+O2(g)==SO2(g)△H1;S(s)+O2(g)==SO2(g) △H2,则:△H1>△H2 |
| B.C(石墨,s)=C(金刚石,S)△H="+1.9" kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 |
| C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(I)△H=﹣57.4 kJ/mol,则:含20 gNaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ |
| D.2C(s)+O2(g)=2CO(g)△H=﹣221 kJ/mol,则碳的燃烧热等于110.5kJ/mol |
C
解析

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
一定条件下,发生反应:①M(s)+N(g)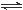 R(g) △H = -Q1 kJ·mol-1,②2R (g)+N(g)
R(g) △H = -Q1 kJ·mol-1,②2R (g)+N(g)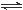 2T (g) △H = -Q2 kJ·mol-1。 Q1、Q2、Q3均为正值。下列说法正确的是
2T (g) △H = -Q2 kJ·mol-1。 Q1、Q2、Q3均为正值。下列说法正确的是
| A.1 mol R(g)的能量总和大于1 mol M(s)与1 mol N(g) 的能量总和 |
| B.将2 mol R (g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ |
C.当1 mol M(s)完全转化为T (g)时(假定无热量损失),放出热量Q1+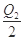 kJ kJ |
D.M(g)+N(g)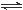 R(g) △H=-Q3 kJ·mol-1 , 则Q3<Q1 R(g) △H=-Q3 kJ·mol-1 , 则Q3<Q1 |
据人民网报道,有一集团拟在太空建立巨大的激光装置,把太阳光变成激光用于分解海水制氢气,其反应式可表示为:2H2O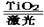 2H2↑+O2↑。有下列几种说法:①水的分解反应是放热反应;②氢气是一级能源;③使用氢气作燃料有助于控制温室效应;④该过程将光能转化为化学能,以上叙述中正确的是
2H2↑+O2↑。有下列几种说法:①水的分解反应是放热反应;②氢气是一级能源;③使用氢气作燃料有助于控制温室效应;④该过程将光能转化为化学能,以上叙述中正确的是
| A.①② | B.②③ | C.③④ | D.①②③④ |
下列说法不正确的是( )
| A.煤经过气化和液化等物理变化可以转化为清洁燃料 |
| B.侯氏制碱法的工艺过程,应用了物质溶解度的差异 |
| C.食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同 |
| D.甘氨酸和丙氨酸发生脱水反应,最多可生成4种二肽 |
下列说法正确的是( )
| A.需要加热才能发生的反应一定是吸热反应 |
| B.化学反应中的能量变化都表现为热量变化 |
| C.任何放热反应在常温下一定能发生反应 |
| D.反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
下列反应属于吸热反应的是( )
| A.碳与水蒸气制水煤气的反应 |
| B.生石灰和水的反应 |
| C.盐酸与氢氧化钠溶液的反应 |
| D.木炭在氧气中燃烧 |
肼(N2H4)是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是
A.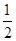 N2H4(g)+ N2H4(g)+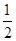 O2(g)=== O2(g)===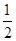 N2(g)+H2O(g) ΔH=+267 kJ·mol-1 N2(g)+H2O(g) ΔH=+267 kJ·mol-1 |
| B.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1 |
| C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 |
| D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1 |
根据四种变化:①Fe(s)→Fe(g);②2H2(g)+ O2(g)=2H2O(g) △H="-482" kJ·mol-1;
③C(s)+CO2(g)=2CO(g);④NaOH(s)=Na+(aq)+OH-(aq)。 请回答下列问题
⑴上述变化中,需要吸收热量的是 (请填变化的代码①②③④,下同)。
⑵上述变化中,体系的混乱度增大的是 。
⑶已知下列两种键能,H-H:436 kJ·mol-1、O-H:463 kJ·mol-1,请计算断裂1 molO2(g)中的共价键需要吸收 kJ的能量。
⑷下面几种说法中。正确的是 [
| A.化合反应都大多是放热反应 |
| B.凡是需要加热的反应,都是吸热反应 |
| C.体系的混乱度增大的反应都是吸热反应 |
| D.中和反应是放热反应,其化学能可以转化成电能 |
下列说法正确的是
| A.物质发生化学变化都伴随着能量变化 |
| B.任何反应中的能量变化都表现为热量变化 |
| C.物质变化时若伴有能量变化,则一定是化学变化 |
| D.没有物质的化学变化,也就没有能量的变化 |