��Ŀ����
����Ŀ��X��Y��Z��W���ֻ��������ԭ������С��18��Ԫ����ɣ�����X��������Ԫ�أ�X��Y��Z����ɫ��Ӧ��Ϊ��ɫ��WΪ��ɫ��ζ���塣�����ֻ������������ת����ϵ(���ַ�Ӧ����P��Ӧ��������ȥ)����ش���
��1��W�Ļ�ѧʽ��______________��
��2��X��Y����Һ�з�Ӧ�����ӷ���ʽ��_________________________________��
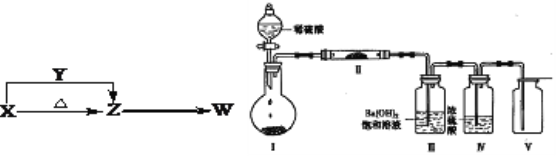
��3��ijʵ��С��������ͼװ��(�г̶ֹ�װ������ȥ)����ʵ�飬װ�â���ΪX��װ�â��в�����ɫ������װ��V�п��ռ���һ����ɫ���塣
��װ�â��з�Ӧ�Ļ�ѧ����ʽ��__________________________________��װ�â�����Ҫ�Ļ�ѧ��Ӧ����ʽ��__________________________________��
�ڢ��е��������������������Ӹ�������______��
���𰸡� CO2 HCO3-+OH-=H2O+CO32- 2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2�� 2Na2O2+2CO2=2Na2CO3+O2 2:1
��������X��Y��Z����ɫ��Ӧ��Ϊ��ɫ����X��Y��Z����NaԪ�أ�X��������Ԫ�أ��ڼ���������������Z����WΪ��ɫ��ζ�����壬X��Y��Z��W���ֻ��������ԭ������С��18��Ԫ����ɣ���XΪNaHCO3��YΪNaOH��ZΪNa2CO3��WΪCO2��
��1�����Ϸ�����֪��W�Ļ�ѧʽ��CO2��
��2��XΪNaHCO3��YΪNaOH�����߷�Ӧ����̼������ˮ�����ӷ���ʽΪ��HCO3-+OH-=CO32-+H2O��
��3����װ�â���ΪX(NaHCO3)����Һ©������ϡ���ᣬNaHCO3��H2SO4��Ӧ���������ơ�ˮ��CO2����Ӧ��ѧ����ʽΪ��2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2����װ�â��в�����ɫ������ӦΪװ�â��з�Ӧ���ɵ�CO2������װ�â��з�Ӧ��ʣ�࣬����װ�â�����������������Һ��Ӧ���ɵ�BaCO3��������Ϊװ�â�ʢ������������������Һ������CO2����ȫ���գ�װ��V���ռ�������ɫ����ӦΪװ�����еĹ�����CO2�ڳ����·�Ӧ���ɵģ���װ�â��й���ΪNa2O2��װ��V���ռ�������ɫ������O2��װ�â�����Ҫ�Ļ�ѧ��Ӧ����ʽ��2Na2O2+2CO2=2Na2CO3+O2���ڢ��е�����ΪNa2O2������Na+��O22-�����������������Ӹ�������2:1��