题目内容
下列说法不正确的是( )
①质子数相同的粒子一定是同一种元素
②质子数相同且电子数也相同的两种粒子不可能一种是分子,另一种是离子
③电子数相同的粒子不一定是同种元素
④一种元素不可以形成不同的单质
⑤某元素的相对原子质量取整数值就是质量数
| A.②④⑤ | B.①④⑤ | C.②③④ | D.①②③④⑤ |
B
解析试题分析:①质子数相同的粒子一定是同一种元素的不同微粒如Na、Na+,也可能是不同元素的微粒如NH3、H2O等。错误。②分子是中性微粒,而离子是带电荷的原子或原子团,它的质子数与电子数不等。因此若某分子一离子的质子数相同,则电子数一定不同。正确。③如OH-、H2O、 NH3的电子数相同,不是同种元素的微粒。正确。④一种元素可以形成多种不同的单质。如白磷与红磷是P元素的不同的单质。错误。⑤某原子的相对原子质量取整数值就是质量数。错误。因此符合题意的说法是①④⑤,选项为B。
考点:考查应该元素、原子、质量数、同素异形体的概念的辨析及应用的知识。

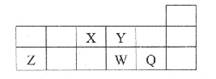
五种短周期元素的某些信息如表所示:
| 元素 | 有关信息 |
| X | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
| Y | M层上有3个电子 |
| Z | 短周期元素中原子半径最大的主族元素 |
| W | 其单质是淡黄色固体 |
| Q | 最高正价与最低负价代数和为6 |
下列说法正确的是
A.简单离子的半径大小顺序为:W>Q>Z>Y
B.Z单质在氧气中燃烧后的产物不能使品红溶液褪色
C.单质熔点高低的顺序为:Z>Y>X
D.Z与W元素只能形成原子个数比为2:1的化合物
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是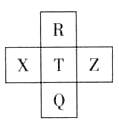
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q |
| D.最高价氧化物的水化物的酸性:T>Q |
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是 
| A.非金属性:Z<T<X | B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q | D.最高价氧化物的水化物的酸性:T>Q |
氯元素的相对原子质量为35.5,氯只有35Cl和37Cl两种稳定同位素,在氯气中35Cl和37Cl的原子个数比为3∶1,则相对分子质量为70,72,74的氯气分子数之比可能是( )
| A.5∶3∶2 | B.5∶2∶2 | C.5∶2∶1 | D.9∶3∶1 |
X、Y、Z是原子序数依次增大的短周期主族元素,X2—、Z+都与Mg2+具有相同的核外电子层结构,下列说法中正确的是
| A.Y元素位于第二周期第ⅦA族或0族 |
| B.X、Y、Z三种元素中非金属性最强的是X元素 |
| C.X、Y、Z三种元素形成的简单离子的半径都比Mg2+半径小 |
| D.Z分别与X、Y形成的化合物都是离子化合物 |
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高正价和最低负价之和为0;Z的非金属性在同周期元素中最强。下列说法正确的是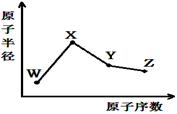
| A.对应气态氢化物的稳定性:Y>Z |
| B.化合物XZW既含离子键也含共价键 |
| C.对应简单离子半径:W>X |
| D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 |
下列说法正确的是 ( )
| A.形成离子键的阴阳离子间只存在静电吸引力 |
| B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |
| C.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| D.元素周期律是元素原子核外电子排布周期性变化的结果 |