题目内容
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是 
| A.非金属性:Z<T<X | B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q | D.最高价氧化物的水化物的酸性:T>Q |
BD
解析试题分析:R单质在暗处与H2剧烈化合并发生爆炸说明R为F,则X、T、Z、Q分别为S、Cl、Ar、Br。A、一般不比较稀有气体的非金属性,A错误;B、R为9号、Q为35号,核外电子数相差26,正确;C、非金属性越强,气态氢化物月稳定,故气体氢化物稳定性为R>T>Q,C错误;D、非金属性T>Q,说明最高价氧化物的水化物的酸性:T>Q,正确。
考点:考查元素周期表结构与元素周期律。

已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,其中X原子最外层电子数是其电子层数的2倍。下列说法正确的是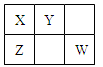
| A.四种元素的原子半径大小rY>rW>rX>rZ |
| B.元素X的含氧酸只有一种,元素Y则有两种 |
| C.元素Z的气态氢化物的稳定性比元素Y的强 |
| D.元素Y和W的氧化物是导致酸雨的主要原因 |
Se是人体必需微量元素,下列有关 Se和
Se和 Se的说法正确的是
Se的说法正确的是
A. Se 和 Se 和 Se所含电子数不同 Se所含电子数不同 | B. Se和 Se和  Se是两种不同的核素 Se是两种不同的核素 |
C. Se和 Se和  Se 分别含有44和46个质子 Se 分别含有44和46个质子 | D. Se和 Se和  Se都含有34个中子 Se都含有34个中子 |
以下是1-18号元素某性质的递变规律,Y轴代表的是 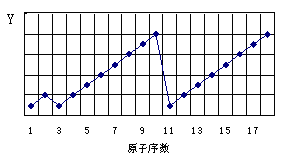
| A.原子半径 | B.金属性 | C.非金属性 | D.最外层电子数 |
今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有
| A.碱性:KOH>NaOH | B.相对分子质量:Ar>K |
| C.酸性:HClO4>H2SO4 | D.元素的金属性:Mg>Al |
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.最高正化合价:③>②>① |
下列说法不正确的是( )
①质子数相同的粒子一定是同一种元素
②质子数相同且电子数也相同的两种粒子不可能一种是分子,另一种是离子
③电子数相同的粒子不一定是同种元素
④一种元素不可以形成不同的单质
⑤某元素的相对原子质量取整数值就是质量数
| A.②④⑤ | B.①④⑤ | C.②③④ | D.①②③④⑤ |
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的内层电子总数是最外层电子数的5倍。下列说法中不正确的是
| A.W、M的某种单质可作为水处理中的消毒剂 |
| B.电解YW2的熔融物可制得Y和W的单质 |
| C.相同条件下,W的氢化物水溶液酸性比Z弱 |
| D.X、M两种元素形成的一种化合物与水反应可生成M的某种单质 |
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
| A.微粒X2-与Y2+核外电子排布相同,离子半径:X2-> Y2+ |
| B.人们可在周期表的过渡元素中寻找催化剂、耐腐蚀和耐高温的合金材料 |
| C.由水溶液的酸性:HCl>HF,可推断出元素的非金属性:Cl>F |
| D.Be元素与Al元素同处在周期表的金属与非金属的交界处,可推出: |