题目内容
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是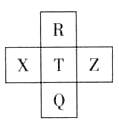
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q |
| D.最高价氧化物的水化物的酸性:T>Q |
BD
解析试题分析:R单质在暗处与H2剧烈化合并发生爆炸,R为F,则T为Cl、Q为Br、X为S、Z为Ar。同周期元素从左至右,非金属性逐渐增大,即非金属性: T>X,Z为稀有气体不考虑,故A错误;R与Q为同主族,电子数相差8+18=26,故B正确;同主族元素从上至下,非金属性逐渐减弱,且非金属性越强,气态氢化物稳定性越大,则气态氢化物稳定性:R >T>Q,故C错误;非金属性越强,最高价氧化物的水化物的酸性越强,则最高价氧化物的水化物的酸性:T>Q,故D正确;答案为BD。
考点:考查了元素周期表结构和元素周期律知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是;
| A.用石墨作电极,电解1mol/LNa2CO3的溶液,溶液的pH值保持不变 |
| B.非金属元素呈现的最高化合价不超过该元素的最外层电子数 |
| C.含8gNaOH的溶液中通入一定量的H2S后,将所得溶液小心蒸干,得无水物7.9g,则该无水物中一定含有Na2S |
| D.使用清洁的天然气是快速、有效地减缓大气中二氧化碳大量增加的生态学措施 |
若某ⅡB族元素原子序数为x,那么原子序数为x+1的元素位于
| A.ⅢA族 | B.ⅢB族 | C.ⅠB族 | D.ⅠA族 |
Se是人体必需微量元素,下列有关 Se和
Se和 Se的说法正确的是
Se的说法正确的是
A. Se 和 Se 和 Se所含电子数不同 Se所含电子数不同 | B. Se和 Se和  Se是两种不同的核素 Se是两种不同的核素 |
C. Se和 Se和  Se 分别含有44和46个质子 Se 分别含有44和46个质子 | D. Se和 Se和  Se都含有34个中子 Se都含有34个中子 |
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是
| | X | Y | |
| W | | | Z |
| T | | | |
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
以下是1-18号元素某性质的递变规律,Y轴代表的是 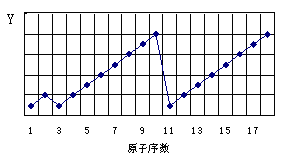
| A.原子半径 | B.金属性 | C.非金属性 | D.最外层电子数 |
今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有
| A.碱性:KOH>NaOH | B.相对分子质量:Ar>K |
| C.酸性:HClO4>H2SO4 | D.元素的金属性:Mg>Al |
下列说法不正确的是( )
①质子数相同的粒子一定是同一种元素
②质子数相同且电子数也相同的两种粒子不可能一种是分子,另一种是离子
③电子数相同的粒子不一定是同种元素
④一种元素不可以形成不同的单质
⑤某元素的相对原子质量取整数值就是质量数
| A.②④⑤ | B.①④⑤ | C.②③④ | D.①②③④⑤ |
O、W、X、Y、Z五种短周期元素在元素周期表中的相对位置如图所示,W是大气中含量最高的元素,由此可知 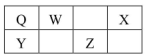
A.Q的一种核素中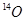 的质子数和中子数相等 的质子数和中子数相等 |
| B.X的最高正化合价与最低负化合价的绝对值之差为6 |
| C.Y是常见的半导体材料 |
| D.Z的氧化物的水化物是强酸 |