��Ŀ����
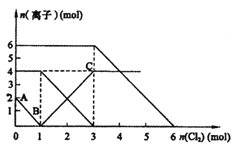
����Ŀ��ijУ��ѧ����С��Ϊ�˼���̼���ƺ�̼���������ְ�ɫ���壬�ò�ͬ�ķ���������ʵ�飬��ͼ��ʾ��
��1��ֻ����ͼI��II��ʾʵ�飬�ܹ��ﵽʵ��Ŀ�ĵ���______________����װ����ţ�2�֣���
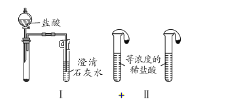
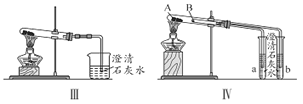
��2��ͼIII��IV��ʾʵ����ܼ������������ʣ����漰�Ļ�ѧ����ʽ��__________��______��
��3����ʵ��III�Աȣ�ʵ��IV���ŵ���________________����ѡ����ţ���
A. IV��III���� B. IV��III��ȫ
C. IV��III������� D. IV����������ͬһ��װ��ͬʱ���������Ա�ʵ�飬��III����
��4������ʵ������֤̼���ƺ�̼�����Ƶ��ȶ��ԣ����Թ�B��װ��Ĺ��������_____���ѧʽ����
��5����0.4 g NaOH��1.06 g Na2CO3��ϲ������Һ������Һ�еμ�0.1 mol��L��1��ϡ���ᡣ����ͼ������ȷ��ʾ������������������CO2�����ʵ����Ĺ�ϵ����__����������ѡ�
A. 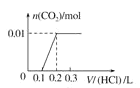 B.
B. 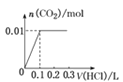
C. 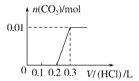 D.
D. 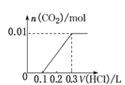
���𰸡�II 2NaHCO3=Na2CO3+CO2��+H2O CO2+Ca(OH)2=CaCO3+H2O D NaHCO3 C
��������
(1)ͨ�����Ũ�ȵ��������Ƚ��������ᷴӦ�����ʿ�����
(4)NaHCO3�����ֽ⣬�������Զ���Դ�¶Ƚϵ͵Ļ����зֽ⣬����Na2CO3�ڿ�����Դ�¶ȽϸߵĻ������Բ��ֽ⣬���ܱȽ������ȶ��IJ��죻
(5)NaOH��Na2CO3�Ļ����Һ�У��������ᣬH���Ⱥ�OH����Ӧ���ٺ�CO32����Ӧ������CO32����H����Ӧ������HCO3����HCO3����H����Ӧ����CO2��H2O��
(1)ͨ��ʵ��Ƚ�Na2CO3��NaHCO3�����ᷴӦ���ʵĿ�����ʵ������Ҫ�������Ũ����ͬ����ͨ���Ƚ�������Ŀ������Ƚ����ʣ����ܴﵽʵ��Ŀ�ģ�
(2)ͼ������NaHCO3��Na2CO3�����ȶ����йأ�NaHCO3�����ֽ⣬�仯ѧ����ʽΪ2NaHCO3![]() Na2CO3+CO2��+H2O��CO2+Ca(OH)2=CaCO3��+H2O��
Na2CO3+CO2��+H2O��CO2+Ca(OH)2=CaCO3��+H2O��
(3)��Ƚ�ʵ���ʵ���ֻҪ����һ�Σ�����ʵ��ʵ��Ŀ�ģ���ʵ�����Ҫ����2�Σ����D������
(4)NaHCO3�����ֽ⣬�������Զ����Դ�¶Ƚϵ͵Ļ����зֽ⣬����Na2CO3�ڿ�����Դ�¶ȽϸߵĻ������Բ��ֽ⣬���ܱȽ������ȶ��IJ��죻�Թ�BԶ����Դ�����װ��NaHCO3���壻
(5) NaOH��Na2CO3�Ļ����Һ�У��������ᣬH���Ⱥ�OH����Ӧ���ٺ�CO32����Ӧ���Ⱥ����ķ�Ӧ�����ӷ���ʽΪH����OH��=H2O��H����CO32��=HCO3����HCO3����H��=CO2����H2O��ֻ�����һ����Ӧ�����������ɡ�
0.4gNaOH�������ʵ���Ϊ0.01mol�����ĵ�HCl�����ʵ���Ϊ0.1mol�����Ϊ![]() ��1.06 g Na2CO3�������ʵ���Ϊ0.01mol��CO32����H����Ӧ������HCO3�������ĵ�HCl�����ʵ���Ϊ0.01mol�����Ϊ
��1.06 g Na2CO3�������ʵ���Ϊ0.01mol��CO32����H����Ӧ������HCO3�������ĵ�HCl�����ʵ���Ϊ0.01mol�����Ϊ![]() ��HCO3����H����Ӧ����CO2��H2O�����ĵ�HCl�����ʵ���Ϊ0.01mol�����Ϊ
��HCO3����H����Ӧ����CO2��H2O�����ĵ�HCl�����ʵ���Ϊ0.01mol�����Ϊ![]() ��ͬʱ����0.01molCO2��ֻ�����һ����Ӧ�����������ɣ���˿�ʼ������0.2L������Һ��û���������ɣ��������0.1L������Һ������0.01molCO2��ͼ��C���ϡ�
��ͬʱ����0.01molCO2��ֻ�����һ����Ӧ�����������ɣ���˿�ʼ������0.2L������Һ��û���������ɣ��������0.1L������Һ������0.01molCO2��ͼ��C���ϡ�